
Mars 2023

Editorial
Après le succès des ateliers d’imagerie du CNCF grâce au comité organisateur et aux experts, succédant au congrès de l’ACC dont notre envoyé spécial François Diévart a assuré la couverture avec le comité de rédaction, j’ai le plaisir de vous présenter le numéro 15 de CardioNews.

LA MINUTE VASCULAIRE
Thromboprophylaxie par aspirine : nouvelles données
Ces données concernent la prévention par aspirine de la MVTE chez les sujets opérés d’une fracture.
Cette prévention nécessaire se fait habituellement par HBPM. par Serge Cohen
LES MOTS MÉDICAUX
Les mots régime et diète bénéficient d’une double lecture à la fois politique et hygiéniste.
par Jacques GauthierLes articles de nos experts
Délai dans les explorations et les traitements cardiologiques : une cause récurrente de plaintes.
Par l’étude de la sinistralité de la MACSF, on s’aperçoit que ce n’est pas sur la démarche intellectuelle en matière de diagnostic que les cardiologues sont mis en défaut. Les plaintes sont plutôt en rapport avec une organisation défaillante des rendez-vous d’explorations ou dans le délai pour mettre en route les traitements spécifiques.
Cela s’explique par une démographie cardiologique en souffrance, une multiplication des différentes explorations et une demande toujours plus forte pouvant provenir d’autres spécialistes. Une étude récente du syndicat national des cardiologues (SNC) rapportait un délai supérieur à un mois pour les différents tests d’ischémie.
À l’occasion du congrès national du CNCF à Strasbourg et par un article dans les Annales de Cardiologie et d’Angéiologie (*), nous avons rapporté plusieurs cas de mises en cause de cardiologues. Deux dossiers concernaient la prescription d’un scanner coronaire devant des douleurs atypiques se compliquant d’un arrêt cardiaque avant leur réalisation. Un autre cas rapportait la survenue d’un AVC suite à la découverte d’une ACFA sur l’interrogation de la mémoire d’un pacemaker, avec absence de prescription immédiate d’un anticoagulant. Enfin, dans les deux derniers cas, les patients sont décédés dans une attente d’un mois pour une revascularisation (angioplastie ou pontage) sur une atteinte tritronculaire.
Pour prévenir ces plaintes, il convient d’abord de porter une attention particulière vis-à-vis des patients les moins diligents et essayer d’organiser pour eux la prise de rendez-vous d’exploration, ou bien fixer avec eux le délai maximal pour obtenir ce rendez-vous. Il est important également d’organiser un canal de retour rapide des résultats d’explorations. Dans l’attente des examens, il faut rappeler les consignes de sécurité (arrêt du sport ou de travail – profession à risque) et parfois instaurer un traitement. Concernant les revascularisations, il faut bien entendu négocier un raccourcissement du délai et renforcer le traitement médical dans l’attente. Dans toutes les situations, il faut demander d’être averti en cas de dégradation des symptômes pour éviter une errance des patients en extrahospitalier.
Enfin, il est surtout indispensable d’assurer une traçabilité de toutes ces précautions notées dans le dossier médical.
C’est à ce prix, que l’on peut réduire au maximum le risque d’accidents et de plaintes liés aux délais en cardiologie
Plaintes liées aux retards dans l’exploration et le traitement des coronaropathies. C Gaultier. sciencedirect.com/science/article/pii/S0003392822001639
Peut-on faire regresser l’athèrome coronaire ?
Peut-on faire tourner les aiguilles de l’horloge à l’envers, peut-on inverser la marche du temps, en d’autres termes peut-on rajeunir ? S’agissant de l’athérome coronaire, la réponse est oui. La plupart des travaux disponibles à ce jour sur la régression des lésions d’athérome coronaire ont été réalisés par “Optical Coherence Tomography” (OCT), technique invasive limitant nécessairement le nombre de sujets étudiés. Avec le développement de logiciels d’IA permettant une quantification de l’athérome coronaire par scanner, la somme des informations disponibles sur le sujet progresse désormais rapidement, sur des séries plus importantes : ces innovations vont modifier en profondeur la notion-même de prévention cardiovasculaire.
Les syndromes coronaires aigus sont précédés d’une nette progression des lésions coronaires : celles-ci sont en effet le plus souvent de sévérité intermédiaire (40-50 %) si l’imagerie (coronarographie ou scanner) est réalisée plus d’un an avant l’événement, mais elles sont nettement plus serrées (70-75 %) lorsque l’imagerie est proche de l’accident (moins de 3 mois). Un syndrome coronaire aigu est donc en règle générale précédé d’une progression rapide de l’athérome coronaire. La définition de la progression ou de la régression n’est pas identique selon qu’elle est évaluée par coronarographie, où l’on ne visualise que l’empreinte de la plaque sur la lumière vasculaire, ou par scanner, qui permet non seulement de voir les plaques dans leur entièreté mais également de différentier leurs composantes lipidique et calcifiée. Une plaque peut ainsi augmenter de volume “vers l’extérieur” sans modifier le degré de sténose mais en altérant les capacités de vasodilatation de l’artère(diminution de la réserve coronaire). Rappelons qu’un nombre croissant d’études montre l’importance du volume total de l’athérome coronaire dans la prédiction du risque d’événement, indépendamment du degré de sévérité des sténoses.
Schématiquement, les statines entrainent une réduction du volume total de l’athérome coronaire qui va de 0 à 20%, selon le dosage utilisé et la durée de l’observation, lorsque les groupes témoins progressent en moyenne de 10 % sur la même période. Plus précisément, la composante calcique des plaques tend à augmenter sous statine (effet“cicatrisation”) alors que leur fraction lipidique diminue, comme le montre l’exemple ci-dessous.
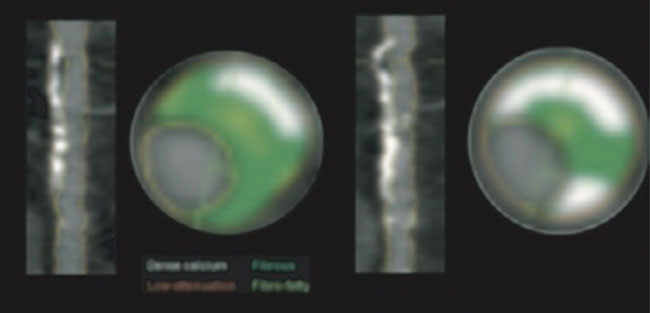
L’hypothèse raisonnablement retenue à l’heure actuelle est que la régression de la plaque est un déterminant important de la diminution des accidents, même si le bénéfice clinique parait plus important que ne le laisserait supposer l’évolution des dimensions de la plaque athéromateuse. Il est probable en effet que d’autres éléments interviennent pour expliquer l’effet protecteur des statines et notamment leur action anti-inflammatoire, comme ont pu le montrer les travaux réalisés en PET-SCANNER. Quoi qu’il en soit, à court-moyen terme, les progrès de l’imagerie par scanner vont permettre de monitorer le devenir des différents composants de la plaque athéromateuse sous traitement, et ainsi d’optimiser la prise en charge individuelle des sujets à risque.
INOCA
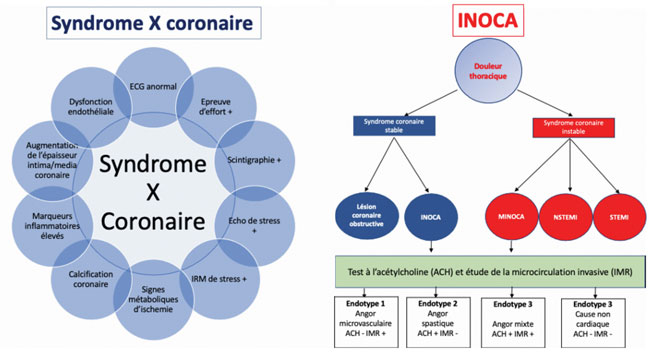
Le syndrome X coronaire décrit dès la fin des années 1970, était défini comme une ischémie documentée sans lésion coronaire. Depuis l’apparition de nouvelles techniques invasives de l’étude de la microcirculation, le syndrome X s’est transformé en Ischemia with Non Obstructive Coronary Arterydisease (INOCA) depuis 2017.
Les différences principales des INOCA avec le syndrome X coronaire sont :
- l’INOCA intègre la recherche de vasoréactivité anormale coronaire ;
- la forme MINOCA correspondant à la version aiguë (troponines positives) des INOCA ;
- l’exploration invasive est standardisée et vient en seconde ligne des explorations non invasives pouvant faire évoquer un INOCA (figure 1)
Figure 1. Classification nosologie des douleurs thoraciques sans attente coronaire épicardique.
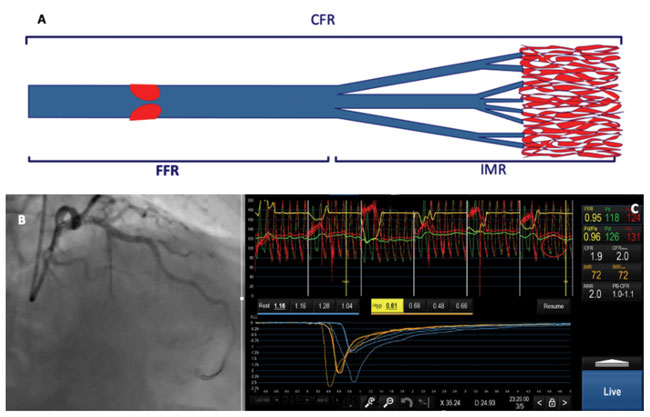
La recherche invasive des INOCA repose sur la recherche d’une vasoreactivité coronaire anormale par le test à l’acetylcholine (ACH) (figure 2) et la recherche d’anomalie de la microcirculation, principalement avec l’index de résistance microvasculaire anormale si > 25 (IMR) (figure 3).
Figure 2.
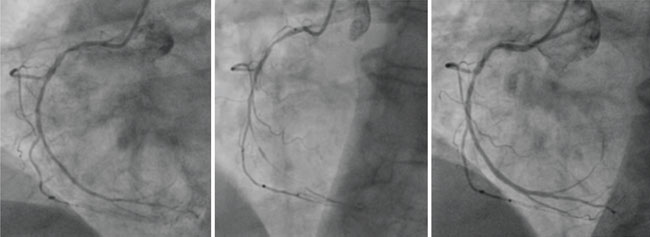
Figure 3.
Endotypes des INOCA
- endotype 1 : Angor microvasculaire (ACH- et IMR+) chez 51 % des patients ;
- endotype 2 : Angor spastique (ACH+ et IMR-) a noter que ce test à l’ACH peut être positif sur le plan épicardique ou purement microvasculaire chez 17 % des patients ;
- endotype 3 : Angor mixte (ACH+ et IMR+) qui est la cause le plus sévère sur le plan pronostique chez 21 % des patients ;
- endotype 4 : Atteinte non cardiaque (ACH- et IMR-) nécessitant la recherche des causes extracardiaques et non somatiques chez 11 % des patients.
Avantages et inconvénients de cette nouvelleclassification INOCA
Cette nouvelle classification permet de mettre en place un organigramme simple de la douleur angineuse aigue ou chronique. La prise en chargedu parcours du patient avec le médecin traitant, le cardiologue non invasif et finalement le cardiologue invasif permet de standardiser in fine le diagnostic invasif et permet d’identifier 4 sous-groupes(endotypes). Les tests choisis ACH et IMR sont objectifs :l’ACH donne des réponses qui laissent peu de place au doute, l’IMR est une valeur numérique. Cette classification est utile sur le plan thérapeutique (notamment la place des bêtabloquants entre l’endotype 1 et 2). Enfin, cette classification est également pratique pour réaliserdes études cliniques.
Les inconvénients de cette classification est qu’elle nécessite une prise en charge invasive avec une procédure dédiée sur le plan logistique. Cependant, il est important de mettre en balance la procédure invasive dédiée à l’errance des patients avec une douleur thoracique suspecte nécessitant multiples hospitalisations et coronarographies blanches. Cette errance est très anxiogène pour les patients et est délétère en terme de qualité de vie. Il a été étudié que le simple fait de trouver le diagnostic et d’adapter les traitements permet d’améliorer significativement la qualité de vie (sans compter la détection parfois extrêmement menaçante de spasme coronaire sévère).
La transition du syndrome X coronaire à l’INOCA a permis une simplification et une standardisation diagnostique, une avancée sur le plan de la recherche clinique et une meilleure détermination des endotypes pouvant mener à des évènements cliniques plus importants. La prise en charge des INOCA permet d’améliorer la qualité de vie et d’éviter une errance médicale anxiogène, consommatrice de soins et invalidante pour la vie de nos patients.
Depuis cette classification, les études rattachent aux INOCA 47 % des coronarographies réalisées pour angor. La prise en charge thérapeutique permet d’améliorer la qualité de vie de plus de 20 % comparé à la coronarographie sans recherche d’INOCA. L’application de ce protocole permet de retrouver une cause coronaire chez la moitié despatients symptomatiques avec une coronarographiedite “normale” et une nette amélioration cliniqueavec l’endotype détecté et traité avec les traitements ciblés.
Évaluation de la fonction ventriculaire droite de la physiologie à la pratique
Dans la moitié des cas l’évaluation de la fonction ventriculaire droite est uniquement qualitative. La quantification se fait par le TAPSE, l’onde Sdti ou la FRSVD, les autres critères sont très peu utilisés.
Une évaluation complète, quantifiée, comprenant le couplage ventriculo-artériel (Ees/Ea) est recommandée.
Couplage ventriculo artériel, phases de décompensation ventriculaire droite
DÉCOMPENSATION VENTRICULAIRE DROITE EN FONCTION DU COUPLAGE VENTRICULO-ARTÉRIEL
Commentaire La physiologie du ventricule droit est différente de celle du ventricule gauche, notamment avec une moins bonne tolérance à la surcharge de pression, mais aussi la nécessité de s’adapter à des pressions 5 fois supérieures à celle de repos.
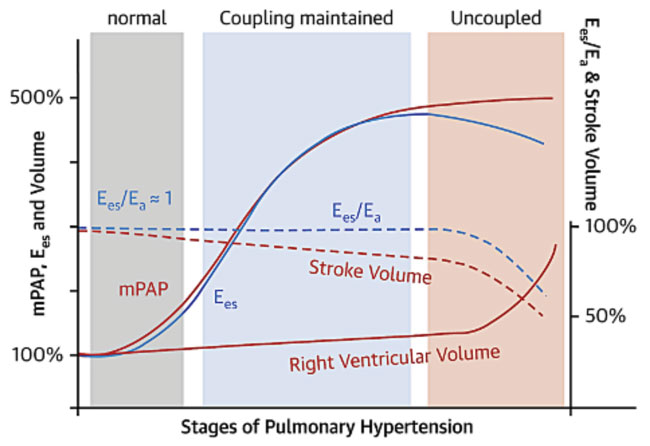
On définit donc trois phases d’évolution ; une phase normale, une phase compensée (couplage efficace) où le transfert d’énergie du ventricule droit vers l’artère pulmonaire est conservé ; l’élastance pulmonaire (Ea qui correspond à la post charge) est compensée par l’élastance ventriculaire droite (Ees), une phase décompensée (découplage V/A) où la contractilité du ventricule droit s’affaiblit (rapport Ees/Ea en baisse) et où le ventricule droit se dilate. Ainsi en phase décompensée la courbe pression/volume est décalée vers la droite (volumes élevés, pressionsstables) et la pente diastolique s’accentue (analysée par l’élastance diastolique Ed).
Le rapport Ees/Ea est corrélé aux fractions TAPSE/PAPS ou VES/VTSVD
A Vonk Nordegraaf http://dx.doi.org/10.1016/j.jacc.2016.10.047
PROTOCOLE DE TRAVAIL
- Optimisation des conditions de charge
- Analyse intégrée
- Index de couplage ventriculo-artériel
- Paramètres diastoliques
- Réserve contractile
- Approche multimodalité
- Cathétérisme
- Adapter les résultats à l’étiologie ; congénitale, post opératoire, surcharge de volume ou pression, maladie cardiaque
Il est important de procéder à l’analyse du ventriculedroit en condition hémodynamique stabilisée.
ANALYSE DU VENTRICULE DROIT
| Echocardiographie | |
| VD diamètres, surface | Radial 33 basal 28 mid, H 71 mm,TD 25 cm2, TS 14 cm2 |
| VD index de remodelage Ts | Risque > 1,6 |
| VD/VG en télédiastole 4c | > 1 |
| Fuite tricuspide | Severe VC 0,7 |
| EVD fonction systolique | |
| TAPSE | < 17 mm |
| TAPSE/sPAP mm/mmHg | < 0,19 risk, > 0,55 no risk(couplage VD/VG) |
| S’ en DTI | < 10 cm/s |
| IVCv cm/sec | < 9 |
| FRSVD | < 36,5 % |
| VD strain paroi libre (3 sgts) | Nl 30%, Basal 19, mid 27, apical 32 (patho > -23 %) GLS 20 % (patho > 15 %) |
| Strain rate | 1,5 basal, 1,7 mid, 2 apex |
| RVMPI mmHg/ml Right ventricle myocardial performance index | 0,28 |
| FEVD 3D echo | Dysfonction Minime 40-45% modérée 30-40% sévère < 30 % |
| IVA moins charge dépendant peu utilisé | Anormal si < 2,2 m/sec |
| EVD pression de remplissage | |
| Épanchement péricardique | Risque si aspect du flux télésystolique 2-3 |
| POD >7 | VCI 21 mm, collaps 50%, Odr strain 15%, E/e’ 10,> Vol OD, 1.7 (E/e’) +0,8 |
| EVD asynchronisme | |
| RV-SD4 msec | > 23 msec |
| IRM | |
| Vol TD VD ml/m2 | > 84 |
| VESVD % (variations sont de bon pronosticrelativement au précédent examen) | > 180, > 227 |
| Rapport M/V VD g/ml (masse/volume) | < 0,45 |
| VTDVG, ml/m2 | Risque majoré < 40 Risque minoré > 58 |
| EVD fonction et couplage | |
| VES indexé ml/m2 | Risque < 25 |
| FEVD % | < 37 % : risque |
| VD VESVD/VTSVD | Risque majoré < 0,53 |
L’analyse de la fonction diastolique permettrait un diagnostic précoce, et l’hypertrophie ventriculaire droite > 5 mm est un mécanisme d’adaptation de meilleur pronostic. Les critères doppler sont ; sur le flux diastolique tricuspide E/A > 2, prédominancediastolique sur le flux veineux cave inférieur. Strain VD ; La forme des courbes de strain en diastole et la diminution de l’amplitude de déformation seraientpéjoratives, de même que la diminution de l’amplitudedu strain OD.
La pente de la fuite pulmonaire est un indice précieux(PHT < 150 msec) de diagnostic d’adiastolie.
Réserve contractile à l’effort ; permet de dépister parmi les patients ayant une dysfonction VD de repos(TAPSE<15), un sous-groupe de meilleur pronostic dont le TAPSE s’améliore > 15.
Quels sont les paramètres retenus pour la décisionthérapeutique (recommandations ESC/ERS)
Les critères péjoratifs sont :
- en échographie une dilatation de l’oreillette droite > 26 cm2, TAPSE/PAPs < 0,19, épanchement péricardique ;
- les critères de volumes sont à recueillir en IRM (FEVD < 37%, VESi < 26 ml/m2 ;
- les pressions sont à recueillir en cathétérisme ; pression OD > 14 mm Hg, IC < 2 l/mn/m2, VESi < 31 ml/m2, SVO2< 60%.
Facteurs limitants : Il est donc nécessaire d’intégrer l’analyse de tous les paramètres (TAPSE, S DTI, FRSVD,IVA pour la stratification périopératoire par exemple). Les seuils de gravité sont différents en cas de maladie congénitale ; Vol TD 150 ml/m2 en cas de Fallot.
En cas d’IT, la contractilité VD est difficile à préciser, un strain de la paroi libre > 19 % serait péjoratif.
Bibliographie : R Lang doi:10.1093/ehjci/jev014
Humbert guidelines ESC/ERS https://doi.org/10.1093/eurheartj/ehac237
Rudski doi:10.1016/j.echo.2010.05.010
Notes
VC : Vena contracta
IVCV : Vitesse de contraction isovolumique
FRSVD -Fraction de raccourcissement duventricule droit
IVA : Isovolumique accélération index
RV-SD4 : Index de désynchronisation sur4 segments en déviation standard
M/V : Masse sur volume
Le prolapsus valvulaire mitralarythmique
Nous rapportons l’histoire d’une patiente de 63 ans, non fumeuse, référée pour la persistance d’une dyspnée avec palpitations. Elle n’allègue aucun antécédent particulier et l’examen clinique retrouve une fréquence cardiaque à 70bpm, avec PA à120/70mmHg sans signes congestifs. Son électrocardiogramme déroule un rythme sinusal avec extrasystoles ventriculaires bigéminées de retard droit (originaires du ventricule gauche), sous décalage ST latéral bas et ondes T plates inférieures (figure 1).
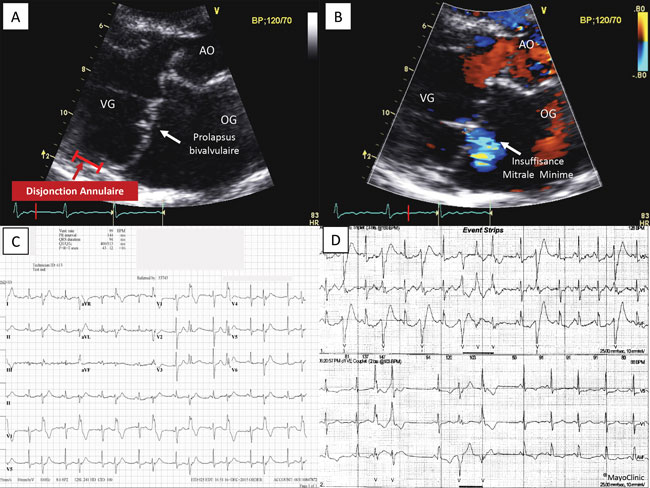
En Échocardiographie-Doppler, le ventricule gauche n’est pas dilaté (DTDVG 56mm, DTSVG 35 mm) ni hypertrophié (SIVd 8 mm) et la fraction d’éjectionVG conservée à 65 %. L’oreillette gauche est légèrement dilatée (42ml/m2) et la valve mitrale épaissie, redondante, siège d’un prolapsus bivalvulaire avec insuffisance mitrale minime. L’analyse de l’appareil mitral retrouve une désinsertion de la structure normale de l’anneau mitral comprenant la jonction auriculo-valvuloventriculaire, et la fixation directe du feuillet mitral postérieur sur la paroi auriculaire (jonction atrioventriculaire). Cette particularité décrivant l’attachement anormal du feuillet mitral postérieur directement sur la paroi atriale caractérise la disjonction annulaire mitrale.
Par ailleurs, le ventricule droit n’est pas dilaté, et les pressions pulmonairessont normales. L’enregistrement Holter-ECG des 24 heures met en évidence plusieurs épisodes de tachycardies ventriculaires non soutenues rapides(160bpm). L’échographie d’effort menée à 4,6 METS est négative pour l’ischémie et la coronarographie diagnostique normale, évoquant le diagnostic de prolapsus valvulaire mitral arythmique.
Le prolapsus valvulaire mitral (PVM) est une des cardiopathies valvulaires les plus fréquentes, affectant environ 2 à 3% de la population générale. Son diagnostic et l’évaluation de son retentissement se font facilement sur la base de l’échocardiographie-doppler. Alors que le pronostic du prolapsus mitral(PVM) est généralement favorable en l’absence de fuite mitrale et ses conséquences ventriculaire et auriculaire gauches, un sous-groupe mal défini d’individus, sans fuite significative, reste à risque plus élevé d’arythmies ventriculaires malignes et de mort subite.
Ce lien entre PVM et mort subite est rapportéavec une incidence annuelle < 1% chez des individus porteurs de PVM non sélectionnés. Cependant, à l’autopsie, la prévalence du PVM chez de jeunes patients atteints de mort subite par arythmie ventriculaire est rapportée entre 4 % et jusqu’à 7 %. En raison du faible taux d’événements et en l’absence de grandes cohortes, l’évaluation de l’incidence précise de la mort subite chez les porteurs de PVM reste difficile à caractériser.
C’est dans ce contextequ’est souvent observée une disjonction annulaire mitrale (ou MAD pour Mitral Annular Disjonction). Ce MAD, qui entraîne un mouvement anormal de l’anneau mitral est lui-même associé à un risque accru d’arythmie. Il fait donc partie intégrante du complexe du prolapsus valvulaire mitral arythmique(PVMA), et des précisions s’imposent quant à sa définition et sa caractérisation.
Le MAD : définition et caractérisation
Le MAD est défini par une séparation en systole, entre le muscle myocardique ventriculaire gauche et l’anneau mitral soutenant le feuillet mitral postérieur. Il se diagnostique en coupe parasternale gauche grand axe, par échocardiographie transthoracique oul’IRM myocardique. La position de l’anneau mitral est mieux identifiée en zoomant sur la valve mitrale en coupe parasternale gauche grand axe, utilisant la fréquence d’images la plus élevée possible et en examinant l’anneau image par image. De cettemanière, la structure mince del’anneau peut être observée du début à la fin de lasystole. À son tour, la localisation précise de la positionannulaire mitrale permet de mesurer la longueur duMAD et la profondeur du PVM.
Le prolapsus valvulaire mitral arythmique (PVMA) : définition et stratification du risque rythmique
Le prolapsus valvulaire mitral arythmique (PVMA) est défini par la présence d’un MVP (avec ou sansMAD), associé à une arythmie ventriculaire fréquente et/ou complexe, en l’absence de tout autre substrat arythmique bien défini (par exemple, ischémie active, cicatrice ventriculaire due à une autre étiologie définie, cardiomyopathie primaire ou canalopathie).La stratification du risque des patients atteints dePVM comprend le recueil d’antécédents ciblés, un ECG 12 dérivations, une surveillance ECG accrue et une échocardiographie transthoracique détaillée.L’utilisation de l’IRM cardiaque et du holter implanta ble est plus sélective, et est indiquée en fonction de la probabilité d’arythmie ventriculaire. Ainsi, la stratification du risque comporte deux étapes, basées sur le contexte clinique et l’imagerie d’une part, et sur le type d’arythmie détectée d’autre part.
Les articles publiés sont sous la seule responsabilité de leurs auteurs. Les informations sur l’état actuel de la recherche et les données présentées sont susceptibles de ne pas être validées par la commission d’AMM.

