
Mars 2024

Editorial
L’année cardiologique s’est ouverte par les journées européennes de la SFC avec les sessions et les recommandations qui enrichissent nos pratiques.

LA MINUTE VASCULAIRE
Les nouvelles recommandations européennes 2024 concernant l’artériopathie : exactement ce qu’on attendait !!!

LES MOTS MÉDICAUX
i.el !
Désavouée par l’académie, l’écriture inclusive se définit comme “l’ensemble des pratiques et contraintes appliquées à la langue afin qu’elle traite également les individus selon leur sexe”.
par Jacques Gauthier (Cannes)
Les articles de nos experts
Le sternum, cet os imposant du thorax a une fonction particulièrement importante : protéger les organes nobles du thorax que sont le coeur et les poumons. Cependant, il est aussi un obstacle pour atteindre la face épicardique du coeur, lieu où le cardiologue et plus particulièrement le rythmologue, aimerait avoir accès dans certaines circonstances.
Dans le cadre du traitement des tachycardies ventriculaires (TV) par ablation, certains foyers arythmogènes sont localisés sur la face épicardique du myocarde et plus particulièrement dans certaines pathologies cardiaques : les myocardites, les maladies auto-immunes avec atteinte cardiaque comme la sarcoïdose par exemple ou la dysplasie arythmogène du ventricule droit.
Dans ces cas, pour avoir accès à la zone épicardique du myocarde, une ponction percutanée rétro-sternale du péricarde est réalisée et permet un abord épicardique pour réaliser ces ablations. Cet abord sous-xyphoidien est aussi utilisé pour réaliser certaines ablations de fibrillation atriale (FA).
En effet, lorsque la FA est ancienne, difficile à ablater par voie endocavitaire classique ou en cas de récidive après une ou plusieurs ablations classiques, il peut être proposé au patient de réaliser une ablation par voie hybride. Cela signifie que le chirurgien cardiaque commence la procédure avec un abord sous-xiphoïdien rétro-sternal pour accéder à la face postérieure de l’oreillette gauche et de réaliser une ablation extensive du mur postérieur de l’oreillette gauche.
Dans un second temps (souvent quelques semaines après), une ablation endocavitaire est réalisée pour compléter les lésions chirurgicales.
Enfin, cet abord est aussi proposé pour l’implantation de nouveaux défibrillateurs sous-cutanés, présentant l’avantage de ne pas avoir de sondes endocavitaires (évitant ainsi le risque d’infection sanguine des sondes par exemple). La limite du DAI sous-cutané actuel (Emblem* de chez Boston Scientific) est qu’il ne peut pas stimuler le ventricule car il est placé sous la peau en avant du sternum et donc pas délivrer des thérapies de stimulation pour arrêter les TV par overdrive, évitant de délivrer un choc électrique.
Un nouveau défibrillateur commercialisé par la société Medtronic (Aurora*) sera bientôt proposé avec une sonde de défibrillation implantée par voie sous-xiphoïdienne, ce qui permettra de pouvoir stimuler le ventricule droit pour traiter une tachycardie ventriculaire avant la délivrance d’un choc ou chez des patients nécessitant une stimulation ventriculaire intermittente rare.
Cette procédure nécessite aussi une collaboration avec un chirurgien cardiaque, qui connait bien les principes de cette voie d’abord et ses complications potentielles.
En effet, ces complications peuvent être potentiellement graves : lésions de la paroi cardiaque avec tamponnade, infections possibles si une sonde est laissée en place, douleurs péricarditiques chez le patient. Pour prévenir ces douleurs, une injection de corticoïdes dans le péricarde en fin de procédure peut être effectuée au cours des ablations épicardiques. Cependant, cet abord reste un vrai challenge pour les rythmologues qui ont besoin de nouveaux outils pour le sécuriser au maximum.
Récemment, il a été proposé de transpercer une veine du sinus coronaire afin d’avoir accès au péricarde et injecter de l’air dans la cavité péricardique pour décoller la paroi cardiaque du feuillet pariétal péricardique et diminuer le risque de léser le myocarde au moment de la ponction péricardique. Des aiguilles avec monitoring de pression ont aussi été proposées pour permettre de repérer le moment du passage dans l’espace péricardique au cours de la ponction.
Ces techniques restent complexes mais nul doute que l’inventivité de l’esprit humain trouvera une parade pour faciliter et sécuriser au mieux l’abord de “cette face cachée du sternum” qui est importante dans plusieurs situations cliniques en rythmologie pour soigner nos patients.
Les traitements des dyslipidémies : quel avenir ? – PARTIE 2 : les nouvelles cibles
La QFR (quantitative flow ratio) est une technique d’évaluation de la sténose coronaire qui vise à évaluer la FFR (fractional flow reserve) de façon moins invasive sans utilisation de guide de pression ni agent vasodilatateur. Contrairement à la FFR, qui mesure la pression sanguine en aval et en amont d’une sténose pour évaluer son impact sur le flux sanguin, la QFR utilise des modèles informatiques et des images angiographiques pour estimer le flux sanguin à partir d’une coronarographie standard de bonne qualité. Cette approche sans guide peut simplifier le processus d’évaluation des sténoses coronaires en éliminant le besoin d’un guide de pression. Cependant, comme pour toute nouvelle technologie, son adoption et son utilisation à grande échelle nécessitent souvent du temps et des études cliniques approfondies pour valider son efficacité et sa fiabilité. En résumé, l’acquisition de deux vues angiographiques permettent de réaliser une reconstruction 3D vaisseaux et d‘y appliquer un algorithme de flux. Celui-ci permet de déterminer la caractéristique du vaisseau d’intérêt d’un point de vue morphologique et fonctionnel (figure ci-dessous).
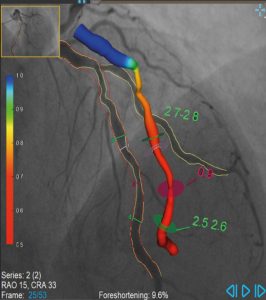
Cette analyse permet d’obtenir une planification de l’angioplastie efficace sur le plan morphologique et fonctionnel. La prédiction diagnostique est haute comparée à la FFR.
L’étude FAVOR III China a montré par ailleurs la superiorité de l’angioplastie guidée par la QFR versus l’angioplastie guidée par l’angiographie seule. Une nouvelle ère s’ouvre sur la physiologie coronaire grâce à l’intelligence artificielle permettant même, en informant la pression aortique moyenne d’obtenir l’état de la microcirculation en estimant l’indice des résistances microcirculatoires (IMR). Ainsi l’IMR angiographique pourrait être également d’une grande aide pour l’évaluation des patients avec angor d’effort sans sténose coronaire obstructive (INOCA).
En résumé, de nombreuses études sont en cours afin de permettre une accessibilité plus grande à l’exploration coronaire macro et microcirculatoire de façon moins invasive. Nous attendons donc avec impatience les résultats de ces études et leurs implications cliniques dans les prochaines recommandations de la Société européenne de cardiologie à paraître prochainement.
Dis-moi quelle est ta FA ?
Le traitement anticoagulant (AC) prévient la survenue des complications thromboemboliques de la FA. Mais en l’absence d’une FA documentée par un ECG, les ACs augmentent le risque d’hémorragie, par exemple chez les patients ESUS, sans démontrer de bénéfice.
Une FA est souvent détectée après la survenue d’un AVC, justifiant la démarche d’un diagnostic précoce pour démarrer un traitement AC.
L’étude LOOP s’est proposée d’implanter un holter chez des patients à risques de FA (CHADS 4). Sur 3 ans 32I% de FA détectées (>6mn) vs 12I% en suivi conventionnel, qui a permis de débuter un traitement AC. Aucun bénéfice sur la survenue d’AVC ou embolie systémique (5I%).
À l’ESC 2023, NOAH-AFNET 6 s’adresse aux patients âgés présentant des épisodes atriaux rapides (>170/mn >6Imn) (AHRE) dans les mémoires de leur stimulateur implanté et des facteurs de risque cliniques d’AVC. L’anticoagulation avec edoxaban à la dose approuvée pour la FA ne réduit pas un résultat composite d’AVC, d’embolie systémique ou de décès cardiovasculaire.
Comme prévu, l’anticoagulation augmente les saignements majeurs. Le taux d’AVC était faible avec et sans anticoagulation.
Sur la base de ces résultats, faut-il anticoaguler les patients avec des « FA non cliniques » diagnostiquées lors d’enregistrements numériques au long cours ? La réponse est non. Ces patients doivent être traités sans anticoagulation jusqu’à ce que la FA soit diagnostiquée par ECG conventionnel à la consultation ; dans l’attente de démembrer la « cardiomyopathie atriale » dont la FA ne serait qu’un symptôme ?
Diabète : quelles sont les nouvelles entités que doit connaitre le cardiologue en 2023 ?
Le diabète est actuellement classé en deux formes principales, le diabète de type 1 et le diabète de type 2, mais les diabètes de l’adulte sont hétérogènes, influencés par l’âge au diagnostic, le degré du déficit de l’insulinosécrétion et le degré d’insulinorésistance lui-même favorisé par le surpoids ou l’obésité.
Dans le cadre de son activité quotidienne le cardiologue doit rechercher systématiquement l’existence d’un diabète ou d’un pré-diabète, et les dernières recommandations de l’ESC rapportent les paramètres biologiques de la World Health Organization de 2019 (WHO) et de l’American Diabetes Association (ADA) de 2021 (tableau ci-dessous).
Tableau. Critères biologiques de la WHO et de l’ADA
| WHO | ADA | |
| Diabète | ||
| Glycémie à jeun (g/L) | ≥ 1,26 g/L | |
| Hyperglycémie provoquée per os | ≥ 2 g/L | |
| HbA1c (%) | ≥ 65 % | |
| Glycémie occasionnelle (g/L) | ≥ 2 g/L | |
| Pré-diabète | ||
| Glycémie à jeun (g/L) | 1,10 – 1,25 g/L | |
| Hyperglycémie provoquée per os | 1,40 – 1,99 g/L | |
| HbA1c (%) | 6,0 – 6,4 % | 5,7 – 6,4 % |
Conclusions
Le diabète auto-immun latent de l’adulte (LADA) :
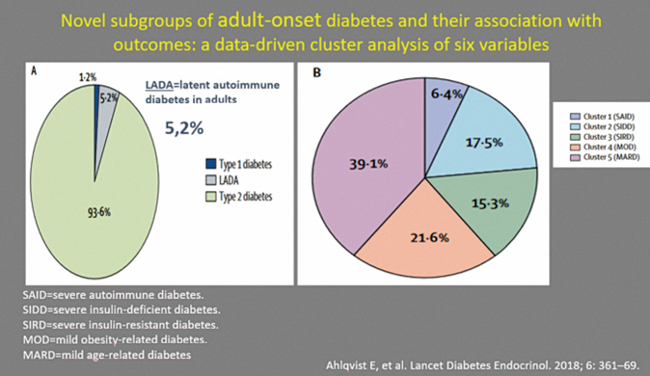
L’Organisation mondiale de la santé (OMS) a révisé en juin 2019 la classification des diabètes, distinguant les formes “hybrides” et notamment le diabète LADA. Le diabète auto-immun latent de l’adulte (LADA), qui représente environ 10% des diabètes chez l’adulte (figure ci-dessous).
Le diabète LADA est une forme de diabète caractérisé par une survenue tardive, et associé à la présence d’autoanticorps, principalement anti-GAD (anticorps anti-glutamate décarboxylase), et nécessitant un traitement par insuline dans les 6 mois qui ont suivi le diagnostic de diabète (2,3,4). Il faut noter qu’il n’y a à ce jour aucune recommandation concernant la recherche éventuelle des anticorps anti-îlots chez l’adulte diabétique. Mais il doit être évoqué devant des patients avec un profil particulier :
- un âge > 30 ans,
- un BMI < 25 kg/m2,
- des symptômes aigus et importants (polydipsie, polyurie, perte de poids),
- une histoire personnelle et familiale de maladie auto-immune,
- une nécessité d’intensifier rapidement le traitement antidiabétique.
La présence d’au moins deux critères doit faire rechercher un LADA par le dosage d’anticorps anti-GAD. Le traitement suit alors les recommandations habituelles mais avec des précautions particulières en ce qui concerne la classe des inhibiteurs du SGLT2 en raison du risque d’acido-cétose diabétique liée à la faible réserve de cellules bêta fonctionnelles (cellules qui sécrètent l’insuline). Et de plus, l’évolution du LADA se fait donc, à plus ou moins court terme, vers l’insulinodépendance avec la nécessité d’introduire un traitement insulinique.
Les autres sous-groupes : le travail de Ahlqvist E, et al, publié dans The Lancet, a étudié des personnes atteintes de diabète selon des critères simples :
a) IMC
b) l’âge au début du diabète,
c) la présence d’anticorps GAD,
d) le niveau HbA1c,
e) Indice HOMA (Homeostasis Model Assessment) qui détermine la résistance à l’Insuline (Ahlqvist E, et al. Lancet Diabetes Endocrinol. 2018;6:361-69).
Ainsi, l’indice HOMA a été développé à partir de la modélisation mathématique des réponses quantitatives des principaux organes du métabolisme du glucose et s’obtient à l’aide d’une valeur plasmatique d’insuline ou de C-peptide et de glycémie à jeun [HOMA= Glycémie à jeun (mmol/L) * Insulinémie à jeun (mui/mL)/22.5]. Les auteurs classifient ainsi les patients en 5 groupes :
- SAID=severe autoimmune diabetes qui correspond principalement au diabète autoimmun de type LADA,
- SIDD = diabète insulino-déficient sévère,
- SIRD = diabète insulino-résistant sévère,
- MOD = diabète léger lié à l’obésité,
- MARD = diabète léger lié à l’âge
Les 5 sous-groupes reproductibles de patients diabétiques présentaient des caractéristiques de patients et un risque de complications diabétiques significativement différents. Par exemple, les patients du groupe 3 (les plus résistants à l’insuline) présentaient un risque significativement plus élevé de maladie rénale diabétique et ceux du groupe 2 (déficit en insuline) présentait le risque de rétinopathie le plus élevé (voir figure.
Au total, la collaboration diabétologue et cardiologue est indispensable mais la connaissance de cette substratification devrait aider le cardiologue à adapter et à cibler les nouvelles thérapeutiques et représente surtout une étape majeure vers une médecine de précision dans les stratégies cardiovasculaires pour le patient diabétique.
De plus, il existe des outils informatiques simples qui permettent d’obtenir cette stratification aisément (à voir ici).
Quels sont les bons candidats à une plastie aortique ?
1 – Contexte clinique
- La chirurgie reconstructrice aortique, devrait être systématiquement discutée en staff multidisciplinaire (Heart Valve Team), chez tout patient adulte jeune porteur d’une IA, associée ou non à un anévrysme de la racine aortique.
- Elle est associée, par rapport au remplacement valvulaire, à un retour à une vie normale sans traitement offrant à ces patients, souvent adultes jeunes, une qualité de vie incomparable.
- Elle reste cependant une procédure sous-utilisée : 21.5% selon le registre Euro Heart Survey II.
- Un double effort de standardisation s’impose ainsi :
– chirurgical afin que les principes techniques et résultats soient plus reproductibles et ainsi enseignés à un plus grand nombre de chirurgiens cardiaques.
– échographique, en élaborant un protocole d’analyse valvulaire et de l’aorte (souvent associé à un CT Scan synchronisé) qui repose sur un langage commun et répond aux questions précises du chirurgien sur la faisabilité d’une plastie aortique (Fig 1).
La faisabilité d’une plastie aortique dépend de 3 facteurs :
- L’analyse valvulaire échographique détaillée par une ETO 2D/3D systématique en pré-op.
- La qualité (souplesse) et la quantité de tissu disponible (absence de rétraction).
- L’expertise du chirurgien, facteur essentiel dans la réussite du geste, à court et long terme.
2-Obtention des vues échographiques et acquisition des mesures (figure 1)
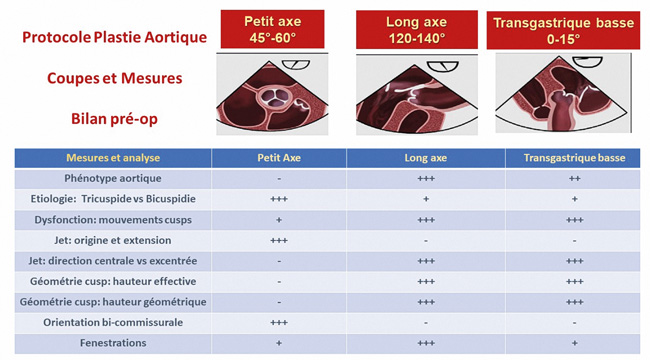
Si certaines mesures sont classiques (les 4 diamètres aortiques par ex) d’autres sont spécifiques, demandées par le chirurgien en vue d’une plastie aortique et doivent être précisément définies :
Géométrie des cusps (figure 2) : hauteur effective (eH) et hauteur géométrique (gH), en mm.
- eH, dont la valeur normale est ≥ 9 mm, est la distance entre le bord libre d’une cusp donnée et le plan de l’anneau, en diastole. Elle permet de mesurer la dysfonction type II ou prolapsus de cusp :
– incomplet si eH < 9 mm mais ≥ 0.
– complet si eH < 0, le bord libre dépassant en diastole le plan de l’anneau.
– gH, défini par la mesure de la hauteur d’une cusp entre son insertion annulaire et le bord libre en systole. Elle permet de mesurer une lésion : la rétraction, qui représente une contre-indication à la plastie, définie par une hauteur géométrique (gH) : < 20 mm dans les valves bicuspides (cusp non fusionnée) et < 18 mm dans les valves tricuspides.
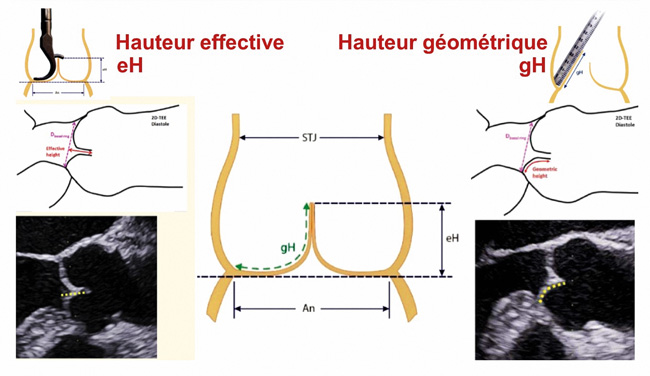
3- Rédaction du protocole écho-chirurgical en vue d’une plastie aortique
1-Phénotype aortique, qui repose sur la mesure de l’anneau aortique, des sinus de Valsalva, de la jonction sino-tubulaire et de l’aorte tubulaire sus-coronaire. 3 phénotypes sont ainsi définis :
- Anévrysme de la racine (sinus de valsalva > 45 mm).
- Anévrysme sus-coronaire (aorte tubulaire > 45 mm).
- Pas d’anévrysme (tous les ϕ < 40-45 mm) : IA isolée.
2-Etiologie : l’étiologie de la maladie valvulaire aortique est fondée sur la distinction entre un phénotype valvulaire bicuspide et un phénotype valvulaire tricuspide. Il s’agit en effet souvent de maladies dystrophiques : Marfan et apparentés, Idiopathiques…
3-Dysfonction : la dysfonction repose sur l’analyse du mouvement des cusps et des caractéristiques du jet.
a/Analyse du mouvement des cusps.
- Type I : mouvement normal.
- Type II : mouvement excessif ou prolapsus.
- Type IIIa : mouvement réduit en ouverture et fermeture (cusp très peu mobile).
- Type IIIb : mouvement réduit en fermeture (diastole) souvent associé à un anévrysme de la racine aortique.
b/ Caractéristiques du jet (au mieux analysé en X-Plan couleur) : origine, extension et direction du jet en petit axe.
4-Lésion : l’étude lésionnelle fait référence à la qualité et à la quantité de tissu valvulaire (mesure de la hauteur géométrique, la présence de calcifications et de fenestrations).
- Rétraction si hauteur géométrique (gH) < 20 mm (bicuspidie) ou < 18 mm (valve tricuspide).
- Calcifications dont on précisera le nombre, la localisation et l’étendue.
- Fenestrations : structures filamenteuses sur les bords libres des cusps aortiques, au niveau des commissures, visibles en long axe.
- Orientation bi-commissurale (en cas de bicuspidie type cusp fusionnée) : si l’angle formé entre les commissures fonctionnelles est < 160°.
Conclusion
la réparation valvulaire aortique est possible, après discussion multidisciplinaire en Heart Team, chez tous les patients (souvent jeunes adultes) atteints de valves bicuspides ou tricuspides, quel que soit le phénotype aortique et le type de dysfonction, mais en l’absence de rétractation valvulaire.
Référence : Berrebi A, Monin JL, Lansac E. Systematic echocardiographic assessment of aortic regurgitation-what should the surgeon know for aortic valve repair ? Ann Cardiothorac Surg. 2019;8(3):331-341.

