
Janvier 2023

Editorial
Une nouvelle année commence et nous en sommes déjà au numéro 14 de la revue Cardionews que vous êtes nombreux à lire en nous témoignant de votre attachement à ce format. Vous retrouverez dans ce numéro 14 nos rubriques habituelles avec la minute vasculaire du Dr Serge Cohen, « Les mots médicaux » du Dr Jacques Gauthier et l’avis toujours pertinent du Dr François Diévart, la thématique des chutes par le Dr Olivier Hanon et bien d’autres sujets…

LA MINUTE VASCULAIRE
Surtraite-t-on les anévrysmes de l’aorte abdominale (AAA) ?
Dans la La réparation élective des AAA est un traitement prophylactique qui prévient la rupture. Il est établi depuis longtemps que le taux annuel de rupture est directement… par Serge Cohen
Les articles de nos experts
Réduire le sinus pour améliorer la perfusion coronaire
Malgré les progrès en cardiologie interventionnelle en terme de revascularisation coronaire, jusqu’à 10 % des patients présentent un angor réfractaire (1). L’angor réfractaire est défini comme des symptômes persistants (3 mois ou plus) dus à une ischémie réversible établie en présence d’une maladie coronarienne obstructive, qui ne peut être contrôlée par une thérapie médicale croissante ou une revascularisation (2). L’angor réfractaire est associé à une mauvaise qualité de vie, à des hospitalisations fréquentes et à un haut niveau d’utilisation des ressources (2).
Parmi l’arsenal thérapeutique, le réducteur du sinus coronaire rapporte un bénéfice clinique pour traiter l’angor réfractaire dans les études. La réduction du sinus coronaire génère un gradient de pression en amont qui entraîne la redistribution du flux sanguin de l’épicarde le moins ischémique vers l’endocarde ischémique (3). Nous avons montré dans une série de cas que la mise en place de ce réducteur du sinus coronaire entrainait une augmentation du flux coronaire et une diminution des résistances microvasculaires (4).
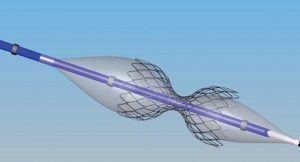
Le réducteur du sinus coronaire est un dispositif métallique en forme de sablier monté sur un ballon permettant de déployer la prothèse en maintenant cette forme de sablier générant une réduction du sinus. Ce dispositif s’implante de façon percutanée par voie veineuse jugulaire droite sous anesthésie locale sous scopie. Les études rapportent une procédure simple, sure et efficace permettant de réduire l’angor réfractaire de 1 à 2 classe CCS (Canadian Cardiovascular Society) dans 80% des cas (5). Une double antiagregationde 6 mois est recommandéeaprès l’implantation.
 Suite à l’obtention d’un remboursement en France, notre expérience est suivie par un registre de la Societé Française de Cardiologie qui est en cours. Nos premières impressions confirment les données de la littérature avec un dispositif simple qui permet de traiter efficacement l’angor réfractaire chez les patients coronariens stables avec une preuve d’ischémie myocardique non revascularisable.
Suite à l’obtention d’un remboursement en France, notre expérience est suivie par un registre de la Societé Française de Cardiologie qui est en cours. Nos premières impressions confirment les données de la littérature avec un dispositif simple qui permet de traiter efficacement l’angor réfractaire chez les patients coronariens stables avec une preuve d’ischémie myocardique non revascularisable.
(1) Mannheimer C, Camici P, Chester MR, et al. The problem of chronic refractoryangina: Report from the ESC Joint Study Group on the treatment of refractoryangina. Eur Heart J. 2002;23:355–70.
(2) Knuuti J, Wijns W, Saraste A, et al. 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes. Eur Heart J. 2020;41:407.
(3) Syeda B, Schukro C, Heinze G, et al. The salvage poten- tial of coronary sinusinterventions: meta-analysis and pathophysiologic consequences. J Thorac Cardiovasc Surg. 2004;127:1703–
(4) Giannini F, Cuenin L, Adjedj J. Impact of the coronary sinus reducer on the coronary artery circulation cases report. Eur Heart J Case Rep. 2022 Apr26;6(6):ytac159.
(5) Verheye S, Jolicoeur EM, Behan MW et al. Efficacy of a device to narrow
Symptômes cardiovasculaires après inhalation de drogues à évoquer…
Dans certains cas d’intoxications résultant d’un comportement addictif à l’égard d’inhalations de drogues ou de substances assimilées, la symptomatologie cardiaque peut apparaître au premier plan et doit être évoquée chez l’adolescent et l’adulte jeune.
Les jeunes français sont les plus grands consommateurs européens, mais aussi pour les cannabinoïdes synthétiques et autres aérosols de diverses natures pouvant exercer leurs toxicités au niveau cardiovasculaire. L’usage régulier du cannabis a augmenté de plus de 40 % ces dernière sannées et la teneur en THC du cannabis a été multipliée par 10 depuis 1980, pouvant atteindre plus de 20 %.
L’âge des intoxications admises aux urgences est de plus en plus jeune et concerne parfois les nourrissons (par inattention parentale). Même si les complications cardiovasculaires desintoxications au cannabis représentent moins de 2 % des complications, elles sont grevées d’une mortalité non négligeable.
Les cannabinoïdes de synthèse sont différents. Ils sont constitués de substances chimiques variées qui sont agonistes des récepteurs aux cannabinoïdes de type CB1 et CB2. Ils peuvent être “vapotés” à l’état liquide, ou fumés après avoir été vaporisés sur du matériel végétal. Ils font une apparition spectaculaire en Europe, à l’instar du continent nord-américain, cannabis et cannabinoïdes de synthèse sont associés à l’apparition chez des sujets souvent très jeunes d’angor, avec ou sans modification biologique ou électrocardiographique, à des syndromes coronariens aigus, et a des infarctus du myocarde.
Certains solvants et propulseurs contenus dans des aérosols de peinture ou autres mais parfois aussi alimentaires (il en existe des centaines…) sont à l’origine d’une addiction redoutable car souvent ignorée de l’entourage, avec un effet euphorisant très bref et relativement difficile à objectiver pour l’entourage. Ces intoxications par inhalation de gaz propulseur peuvent êtreassociées à des spasmes coronariens, des troublesdu rythme ventriculaire, voire des morts subites.
Il est nécessaire pour le cardiologue d’évoquer ces diagnostics devant une angine de poitrine ou syndrome coronarien aigu, ou un trouble du rythme inexpliqué chez l’enfant, l’adolescent ou l’adulte jeune agité et incohérent. Ces intoxications, hormis pour le cannabis, échappent généralement au diagnostic biologique et doivent faire l’objet d’un interrogatoire soigneux, si besoin à l’écart des parents.
L’abus de cocaïne, heureusement rare chez l’enfantet l’adolescent, est relativement toxique pour le système cardiovasculaire. Contrairement aux amphétamines et aux cannabinoïdes qui ont un mécanisme d’action limité, la cocaïne est non seulement hautement addictive, mais exerce un effet ubiquitaire sur le système cardiovasculaire avec pour conséquence l’apparition possible d’arythmies, ou de tableaux d’insuffisance coronarienne aigüe, d’insuffisance cardiaque, d’hypertension artérielle, de modifications électrocardiographiques évoquant un syndrome de Brugada, d’HTAP, et de dissection aortique, devant faire évoquer la prise de cette drogue chez le sujet jeune.
Une année d’insuffisance cardiaque en 2022
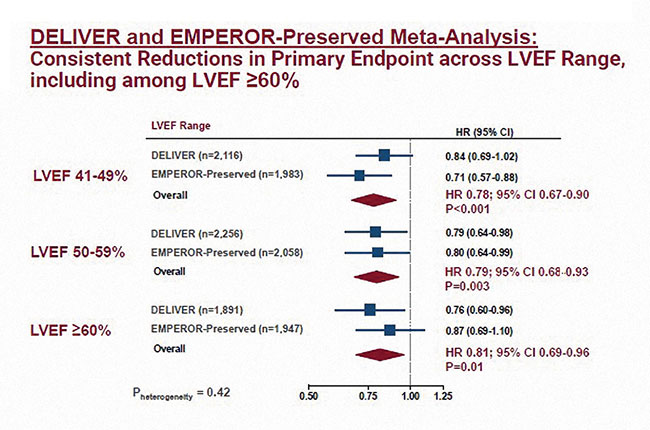
Année riche tout d’abord avec des recommandations ACC-AHA complémentaires de l’ESC21 puisqu’elles intègrent les iSGLT2 dans toutes les IC en particulier préservées. On a vu à l’ACC 22 l’étude Diamond montrant que l’usage du patiromer, une résine échangeuse de K+, permet de préserver l’usage de MRA et on l’espère donc d’événement CV. Le Mavacamten avec Valor-HCM montre qu’un modulateur de la myosine réduit fortement de 77 % le recours à une stratégie invasive dans la CMHO. Au passage l’ACC est revenu sur EMPULSE qui assoit, après Soloist, l’usage précoce de gliflozine en phase hospitalière après une décompensation dès la 72e heure en toute sécurité rénale. À l’ESC on s’est replongé dans les diurétiques lors de l’ICA avec la réapparition de l’acetazolamide (étude ADVOR) qui fait mieux qu’une stratégie furosemide avec réduction de la congestion et de la durée de l’hospitalisation (-1j). Mais surtout la saga des gliflozines a vu l’épisode IV avec DELIVER qui confirme Emperor preserved, en réduisant le Mace (décès CV et Hospitalisations) de 18 %, grâce à une baisse de 21% des rehospitalisations. Le NNT est spectaculaire à 32. Lorsque les deux études ICFEP sont poolées, on démontre une baisse du Mace de 20 %, des hospitalisations de 26 % et de la mortalitéCV de 12 %, le tout de manière très homogène quelque soit le sous-groupe de FE. Les gliflozinessont intronisées en tant que traitement de toutes lesIC (cf metaanalyse des 5 essais iSGLT2 et IC).
Est-ce que l’étape d’après ne devrait-elle pas être « à introduire par le MG sur dyspnée BNP élevé avant la caractérisation ultérieure par le cardiologue en echo » ? Vivement leur upgrade dans les recos en IA pourtous. L’AHA a été très interessant avec deux études impactant nos futurs parcours de soins de l’IC.COACH est une étude scorant le risque des IC aigues vs soins usuels pour renvoyer à la maison les moins graves / -12 % du Mace à 30 j et encore -5 % à 20 mois.
STRONG-HF est une étude française (devenues rares à l’AHA) qui fait la promotion d’une stratégie agressive de titration (à 50 % des doses cibles en phase d’hospitalisation) suivie de titration-consultations à S1, S2, S3 et S6, avec un résultat favorable mais modéré de baisse des hospitalisations à 180 j de 8,1 % et ce pour une population témoin assez bien traitée. Ces deux études doivent nous pousser à revoir nos parcours de soins en intégrant des IPA pour faire vivre ces semaines rapprochées de consultation. IRONMAN conforte l’importance de fer injectable pour traiter la carence martiale tant pour la baisse des hospitalisations que pour la qualité de vie.
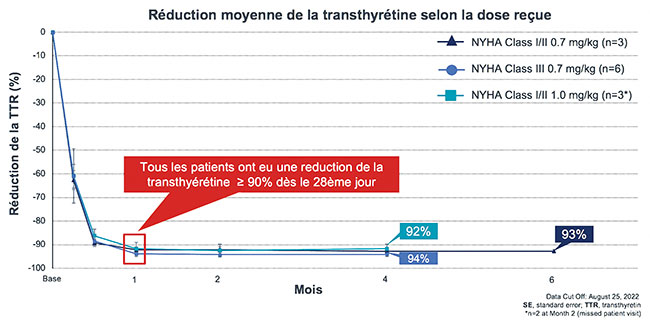
Enfin, l’avenir et déjà le présent avec le premier micro essai en cardiologie sur 12 personnes d’une thérapie génique utilisant le ciseau génétique CRISPR-CAS9 via une injection unique de NTLA-2001 sur le gène de l’amylose à TTR héréditaire, ce qui effondre de 9 0 % les taux sériques de TTR de manière stable à 3 et 6 mois. Il s’agit là vraiment d’une révolution dans notre approche.
Diabète de type 2 : le changement de paradigme est officialisé
Pendant des décennies, la stratégie de prise en charge du diabète de type 2 (DT2) a reposé sur la diminution de la glycémie et donc de l’HA1c, afin par ce biais d’en réduire les complications. Le choix des traitements se faisait en fonction de leur effet sur l’HbA1c, de leur tolérance (notamment du risque d’hypoglycémies), de la fonction rénale…
Mais, depuis 2015, plusieurs essais thérapeutiques contrôlés conduits contre placebo ont démontré qu’à diminution similaire de l’HbA1c, les différents traitements du DT2 pouvaient avoir des effets cliniques très différents, avec pour les agonistes des récepteurs du GLP1 (arGLP1), une réduction du risque d’AVC et d’IDM, pour les gliflozines, une réduction du risque d’insuffisance cardiaque (IC) et d’événements rénaux majeurs et pour les iDPP4, aucun bénéfice clinique.
En 2022, ces évolutions ont été pleinement prises en compte dans un document de consensus des sociétés savantes de diabétologie américaine (ADA) et européenne (EASD). Ces recommandations changent le paradigme en distinguant dorénavant deux grandes stratégies définies par leurs objectifs prioritaires : réduire le risque CV ou rénal dans un cas, réduire la glycémie ou le poids dans l’autre cas.
Pour 4 types de patients ayant un DT2 l’objectif prioritaire est de réduire le risque CV ou rénal. Ces ont ceux en prévention CV secondaire et ceux à risque CV élevé définis par un âge au moins égal à 55 ans et ayant deux autres facteurs de risque CV. Dans ce cas, un ar-GLP1 et/ou une gliflozine sont préférentiellement à proposer. Il y a ceux ayant une IC et dans ce cas, une gliflozine est à proposer. Il y a ceux ayant une maladie rénale chronique, définie par un débit de filtration glomérulaire inférieur à 60 ml/min/1,73 m2 ou par un rapport albuminurie sur créatininurie supérieur à 30 mg/g : dans ce cas une gliflozine doit être proposée et, en cas de mauvaise tolérance, un ar-GLP1 doit être proposé.
Chez ces 4 types de patients, l’ar-GLP1 ou la gliflozine doivent être proposés indépendamment de la valeur de l’HbA1c ou de la prescription de metformine.
Dans le deuxième objectif, si la priorité est de diminuer l’HbA1c, la metformine peut être utilisée ou une association thérapeutique, et il est indiqué que le traitement le plus efficace sur cet objectif est un ar-GLP1 et, si la priorité est de diminuer le poids, il est aussi indiqué que le traitement le plus efficace est un ar-GLP1.
Un constat : dans plusieurs situations cliniques, le choix du traitement à utiliser est prioritaire parrapport à l’atteinte de l’objectif glycémique.
Le prolapsus valvulaire mitralarythmique
Nous rapportons l’histoire d’une patiente de 63 ans, non fumeuse, référée pour la persistance d’une dyspnée avec palpitations. Elle n’allègue aucun antécédent particulier et l’examen clinique retrouve une fréquence cardiaque à 70bpm, avec PA à120/70mmHg sans signes congestifs. Son électrocardiogramme déroule un rythme sinusal avec extrasystoles ventriculaires bigéminées de retard droit (originaires du ventricule gauche), sous décalage ST latéral bas et ondes T plates inférieures (figure 1).
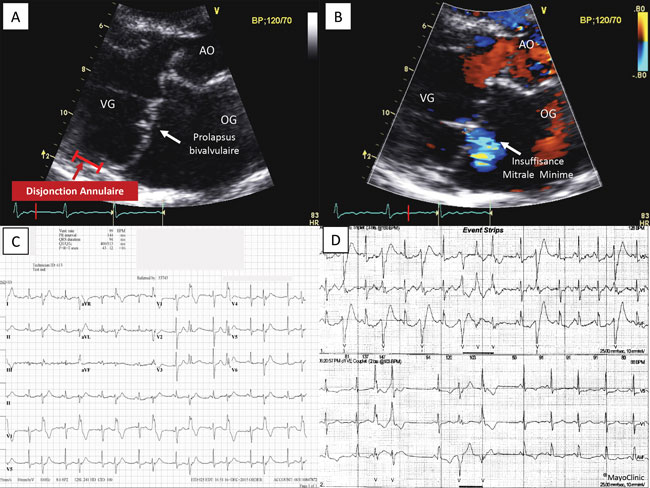
En Échocardiographie-Doppler, le ventricule gauche n’est pas dilaté (DTDVG 56mm, DTSVG 35 mm) ni hypertrophié (SIVd 8 mm) et la fraction d’éjectionVG conservée à 65 %. L’oreillette gauche est légèrement dilatée (42ml/m2) et la valve mitrale épaissie, redondante, siège d’un prolapsus bivalvulaire avec insuffisance mitrale minime. L’analyse de l’appareil mitral retrouve une désinsertion de la structure normale de l’anneau mitral comprenant la jonction auriculo-valvuloventriculaire, et la fixation directe du feuillet mitral postérieur sur la paroi auriculaire (jonction atrioventriculaire). Cette particularité décrivant l’attachement anormal du feuillet mitral postérieur directement sur la paroi atriale caractérise la disjonction annulaire mitrale.
Par ailleurs, le ventricule droit n’est pas dilaté, et les pressions pulmonairessont normales. L’enregistrement Holter-ECG des 24 heures met en évidence plusieurs épisodes de tachycardies ventriculaires non soutenues rapides(160bpm). L’échographie d’effort menée à 4,6 METS est négative pour l’ischémie et la coronarographie diagnostique normale, évoquant le diagnostic de prolapsus valvulaire mitral arythmique.
Le prolapsus valvulaire mitral (PVM) est une des cardiopathies valvulaires les plus fréquentes, affectant environ 2 à 3% de la population générale. Son diagnostic et l’évaluation de son retentissement se font facilement sur la base de l’échocardiographie-doppler. Alors que le pronostic du prolapsus mitral(PVM) est généralement favorable en l’absence de fuite mitrale et ses conséquences ventriculaire et auriculaire gauches, un sous-groupe mal défini d’individus, sans fuite significative, reste à risque plus élevé d’arythmies ventriculaires malignes et de mort subite.
Ce lien entre PVM et mort subite est rapportéavec une incidence annuelle < 1% chez des individus porteurs de PVM non sélectionnés. Cependant, à l’autopsie, la prévalence du PVM chez de jeunes patients atteints de mort subite par arythmie ventriculaire est rapportée entre 4 % et jusqu’à 7 %. En raison du faible taux d’événements et en l’absence de grandes cohortes, l’évaluation de l’incidence précise de la mort subite chez les porteurs de PVM reste difficile à caractériser.
C’est dans ce contextequ’est souvent observée une disjonction annulaire mitrale (ou MAD pour Mitral Annular Disjonction). Ce MAD, qui entraîne un mouvement anormal de l’anneau mitral est lui-même associé à un risque accru d’arythmie. Il fait donc partie intégrante du complexe du prolapsus valvulaire mitral arythmique(PVMA), et des précisions s’imposent quant à sa définition et sa caractérisation.
Le MAD : définition et caractérisation
Le MAD est défini par une séparation en systole, entre le muscle myocardique ventriculaire gauche et l’anneau mitral soutenant le feuillet mitral postérieur. Il se diagnostique en coupe parasternale gauche grand axe, par échocardiographie transthoracique oul’IRM myocardique. La position de l’anneau mitral est mieux identifiée en zoomant sur la valve mitrale en coupe parasternale gauche grand axe, utilisant la fréquence d’images la plus élevée possible et en examinant l’anneau image par image. De cettemanière, la structure mince del’anneau peut être observée du début à la fin de lasystole. À son tour, la localisation précise de la positionannulaire mitrale permet de mesurer la longueur duMAD et la profondeur du PVM.
Le prolapsus valvulaire mitral arythmique (PVMA) : définition et stratification du risque rythmique
Le prolapsus valvulaire mitral arythmique (PVMA) est défini par la présence d’un MVP (avec ou sansMAD), associé à une arythmie ventriculaire fréquente et/ou complexe, en l’absence de tout autre substrat arythmique bien défini (par exemple, ischémie active, cicatrice ventriculaire due à une autre étiologie définie, cardiomyopathie primaire ou canalopathie).La stratification du risque des patients atteints dePVM comprend le recueil d’antécédents ciblés, un ECG 12 dérivations, une surveillance ECG accrue et une échocardiographie transthoracique détaillée.L’utilisation de l’IRM cardiaque et du holter implanta ble est plus sélective, et est indiquée en fonction de la probabilité d’arythmie ventriculaire. Ainsi, la stratification du risque comporte deux étapes, basées sur le contexte clinique et l’imagerie d’une part, et sur le type d’arythmie détectée d’autre part.
Les articles publiés sont sous la seule responsabilité de leurs auteurs. Les informations sur l’état actuel de la recherche et les données présentées sont susceptibles de ne pas etre validées par la commission d’AMM.

