
Septembre 2022

Editorial
Merci à tous les experts fidèles qui travaillent
activement pour nous produire des rubriques de qualité et vos retours nous confirment qu’ils répondent à vos attentes.
La bonne collaboration avec le Syndicat national des cardiologues, la SFC et le CNCH nous permet de réaliser des actions communes dans l’intérêt de la cardiologie, et plus particulièrement de la cardiologie libérale qui nous tient évidemment à cœur.

LA PAROLE À
François Diévart
Co-président d’Infocard
Association de formation continue des médecins spécialistes du cœur et des vaisseaux de la région des Hauts-de-France
LA MINUTE VASCULAIRE
Simple ou double anti-agrégation plaquettaire (DAPT) avant endartériectomie carotidienne ?
Les articles de nos experts
Nombreux sont les exemples d’innovations qui ont été accueillis avec réticence avant d’avoir été acceptés. Ce processus est initialement tout à fait attendu car il se heurte au défaut de maturité de cette innovation, de définir la population cible qui en bénéficiera le plus et de bousculer les idées reçues.
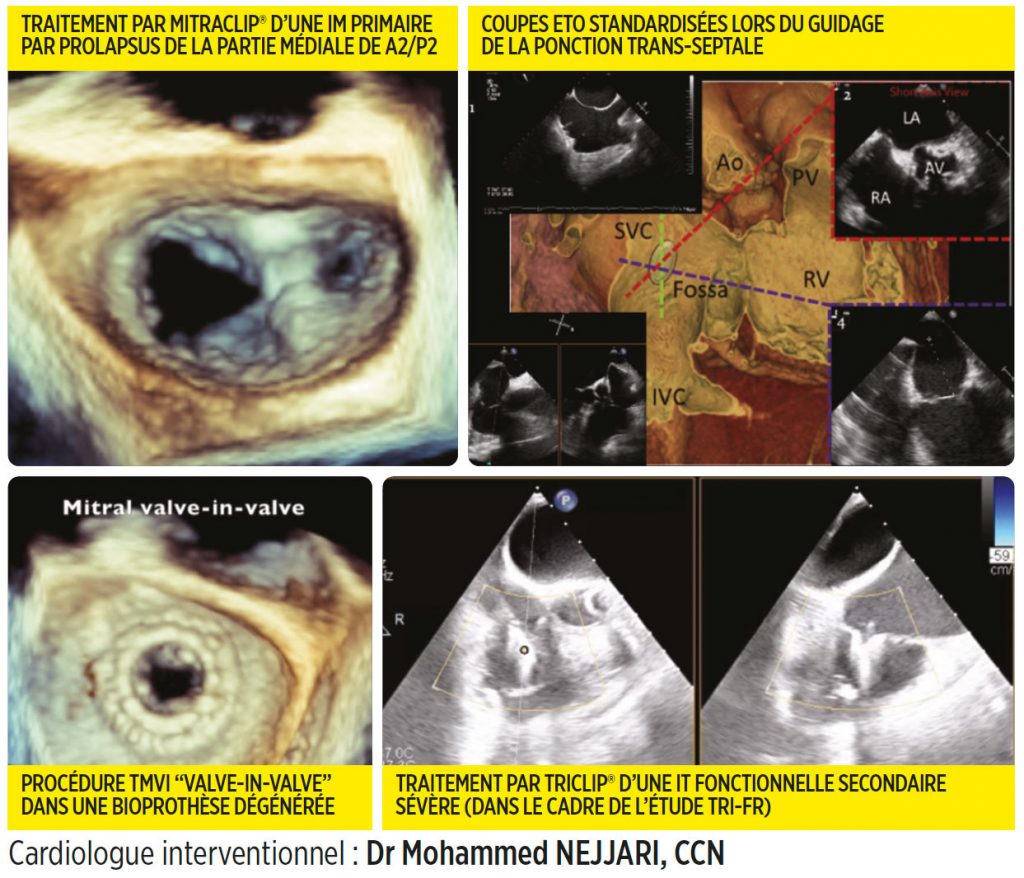
Les dernières années ont vu le développement de la cardiologie interventionnelle dite « structurelle », permettant le traitement percutané de pathologies variées : valvulopathies (rétrécissement mitral par commissurotomie mitrale percutanée, insuffisance mitrale et/ou tricuspide par réparation percutanée bord à bord, remplacement valvulaire mitral et/ou tricuspide par voie percutanée, procédure valve-in-valve/ring/MAC mitrale et/ou tricuspide, fermeture de fuites para-prothétiques), fermeture percutanée de l’auricule gauche, fermeture de CIA ou de FOP.
Ces procédures sont en pleine expansion, certaines techniques ayant été validées par des essais randomisés de grande taille. Ainsi les dernières recommandations ESC 2021 sur les valvulopathies ont positionné le traitement percutané de l’IM secondaire en recommandation de grade IIa, devant la chirurgie, une fois le traitement médical de l’insuffisance cardiaque optimisé. Elles ont également ouvert la porte au traitement percutané de l’insuffisance tricuspide fonctionnelle chez les patients fragiles.
Le succès de ces procédures est lié à la collaboration entre le cardiologue interventionnel et l’échographiste interventionnel dont l’expertise est requise à toutes les étapes de la prise en charge du patient : screening clinique et échographique avant la procédure, guidage pendant la procédure, suivi.
L’analyse de la faisabilité de ces procédures a été rendue possible par l’imagerie multimodalité avec l’avènement de l’ETO 3D et des différents outils de reconstruction et d’analyse (x-plan, zoom 3D, Quick-view, MPR, planimétrie 3D) qui permettent une description anatomique précise et un positionnement du device à l’endroit souhaité, parfois au millimètre près. Un complément d’analyse par scanner dédié est parfois nécessaire, notamment pour les procédures de remplacement valvulaire mitral ou de TAVI mitral.
Le guidage pendant la procédure demande à l’échographiste interventionnel de connaître, ou plutôt de réapprendre l’anatomie en vue de la procédure, de manière à pouvoir dégager la vue échographique la plus adaptée à chaque étape. Pour cela, il est nécessaire d’avoir un langage commun avec le cardiologue interventionnel par le biais d’incidences standardisées (pour la ponction transseptale par exemple) et d’une dénomination standardisée (segmentation chirurgicale de la valve mitrale, description anatomique précise de la valve tricuspide).
Connaître le design et les différentes tailles des devices, leurs indications anatomiques respectives et les complications potentielles immédiates en salle de KT est également indispensable. Les principales complications immédiates sont la tamponnade (pour toutes les procédures) et l’obstruction sous-aortique en cas de TAVI mitral.
Enfin, ce « nouveau métier » se rapproche de celui de l’interventionnel par la nécessité d’être pragmatique et de prendre ensemble des décisions importantes, permettant de partager les succès mais aussi les complications inhérentes à ces procédures. Le volume de procédures, le débriefing et la remise en question permanente mais constructive sont des éléments clés de la progression. Nous vous invitons à venir nous rejoindre pour commencer ou parfaire votre formation !
L’échographie peropératoire est apparue dans les années 1980 avec l’apparition des premières sondes échos transthoraciques permettant une écho épicardique : en effet on venait de loin puisque les chirurgiens utilisaient un stéthoscope qu’ils posaient sur le cœur afin de vérifier l’absence de souffle résiduel ! Le véritable tournant évolutif fut l’apparition des premières sondes écho transœsophagienne (ETO) et sous l’impulsion d’Alain Carpentier, qui en comprit immédiatement l’intérêt, furent utilisées la première fois à l’hôpital Broussais en1985.
Le concept d’échographie peropératoire systématique était né et ce faisant celui d’échographiste per-opératoire dédié avec initialement les docteurs Jean Viossat et Serban Mihaileanu. Puis sont apparues les sondes multiplan et surtout, en2000, la révolution des sondes 3D matricielles permettant une visualisation en temps réel des vues chirurgicales facilitant la communication entre échographistes et chirurgiens.
Les objectifs de l’ETO per-op, systématique dans toute chirurgie valvulaire (plastie ou remplacement) sont d’une part en pré-op d’identifier précisément le mécanisme de la dysfonction pour mieux planifier le geste opératoire et d’autre part en post-op immédiat de contrôler le résultat fonctionnel sur un cœur battant afin de détecter une fuite résiduelle qui selon la sévérité et surtout son mécanisme peuvent conduire le chirurgien à repartir en CEC, véritable filet de sécurité pour le chirurgien et le patient.
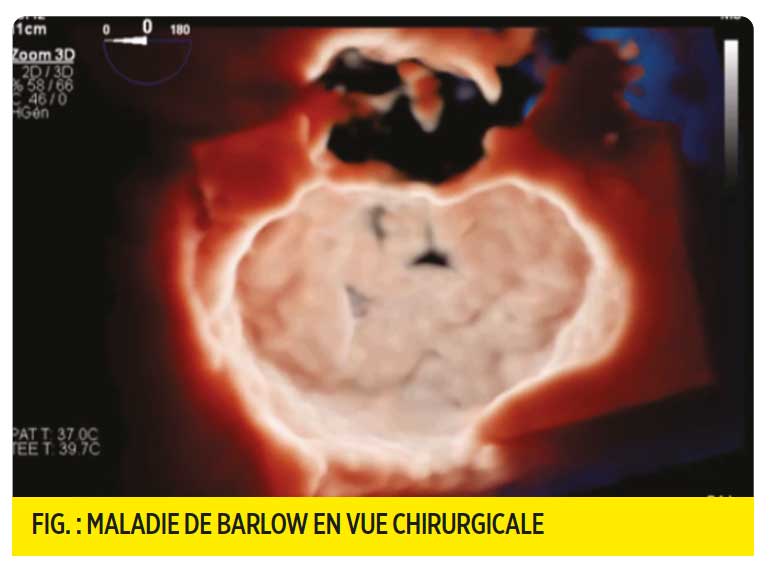
L’analyse valvulaire préopératoire repose sur un langage commun fondé sur la triade physiopathologique qui sépare la maladie, les lésions et la dysfonction : cela est fondamental en particulier pour les plasties mitrales où le compte rendu identifiera cinq chapitres pour le chirurgien avec l’analyse :
1/ De la dysfonction reposant sur le type de dysfonction et l’analyse segmentaire (localisation de la dysfonction grandement facilitée par les vues chirurgicales 3D).
2/ Des lésions en particulier les ruptures de cordages et surtout l’existence de calcification pouvant gêner le chirurgien.
3/ De l’étiologie en séparant dans le cadre des maladies dégénératives la maladie de Barlow du sujet jeune et la dégénérescence fibroélastique du sujet âgé.
4/ du risque de SAM (Systolic Anterior Motion).
5/ de la tricuspide, à ne pas oublier, en particulier la mesure de l’anneau qui, dilaté à plus de 40 mm, peut conduire le chirurgien même en l’absence de fuite importante, à réaliser une plastie tricuspide associée au geste mitral.
L’analyse postopératoire débutera par la mesure de la coaptation, l’existence d’une fuite résiduelle dont il faudra comprendre surtout son mécanisme afin de guider le chirurgien sur le geste précis à réaliser (déhiscence sutures de résection, cordage artificiel trop long ou trop court…).
On vérifiera l’absence de SAM et enfin appréciera les structures environnantes (valve aortique, circonflexe…) pour terminer par l’analyse des fonctions VG/VD et du remplissage. L’échographiste au bloc opératoire, anesthésiste ou cardiologue, s’est naturellement invité comme un partenaire bienveillant mais exigeant dont la présence systématique permet de détecter environ 7 à 10 % de fuites immédiates, et ce faisant permet de réduire significativement le risque de réopérations plus ou moins tardives.
Il s’agit là d’un des volets de l’activité de l’échographiste interventionnel, à savoir l’aspect peropératoire en chirurgie cardiaque. Il existe un autre volet qui se développe de plus en plus consacré aux thérapies percutanées valvulaires en salle hybride.
Maladie thromboembolique au décours de l’infection à la Covid-19
La Covid-19 a entraîné une crise sanitaire, responsable de millions de décès dans le monde. Les symptômes sont variables en fonction des patients, la manifestation grave la plus courante étant la pneumonie avec syndrome de détresse respiratoire aiguë. Des études récentes ont démontré une incidence accrue des complications cardiovasculaires, notamment les infarctus du myocarde et les accidents vasculaires cérébraux.
Les études sur la survenue d’événements thromboemboliques veineux (ETEV) ont donné des résultats contradictoires. Une métaanalyse rapporte une incidence d’ETEV d’environ 13 %, cependant, l’étude incluait principalement des patients atteints de Covid-19 sévère pendant la première vague de la pandémie. Un autre rapport, incluant des études avec un groupe de contrôle, n’a pas montré un taux accru d’ETEV, à l’exception des patients admis en réanimation. Une vaste étude menée en Angleterre à l’aide de dossiers médicaux électroniques a révélé que 4 671 patients ont été admis à l’hôpital en raison d’ETEV dans les 28 jours suivant un test positif pour le SRAS-CoV-2. Le ratio du taux d’incidence d’ETEV était environ 14 fois plus élevé au cours des deux premières semaines, puis diminuait pour être multiplié par huit au cours de la troisième semaine et par trois au cours de la quatrième.
Très récemment, le registre proposé par Katsoularis et al confirme un risque très élevé d’ETEV pendant l’infection à la Covid-19.
Cette étude a utilisé une cohorte nationale suédoise composée de toutes les personnes dont le test de dépistage du SRAS-CoV-2 était positif, quelle que soit la gravité de la maladie. Plus d’un million de patients pendant la période mars 2020-mai 2021 ont été suivis. Le risque d’ETEV dans la phase aiguëe st particulièrement élevé. Le risque relatif d’embolie pulmonaire est multiplié par 39 au moment du diagnostic, et par 46 entre le 8e et le 14e jour. Un risque accru d’ETEV est observé jusqu’à trois mois après la Covid-19, d’embolie pulmonaire jusqu’à six mois, et d’événement hémorragique jusqu’à deux mois.
Plusieurs mécanismes expliquent ce risque élevé de survenue d’ETEV : un effet direct du virus sur les cellules endothéliales, une réponse inflammatoire exagérée, une régulation à la baisse des récepteurs de l’enzyme de conversion de l’angiotensine 2 et une activation du système de coagulation. L’incidence des embolies pulmonaires est beaucoup plus élevée, ce qui pourrait être dû à un phénomène d’immunothrombose (thrombose dans les vaisseaux pulmonaires due à une inflammation locale). Ces données récentes sont en faveur d’un bénéfice d’une anticoagulation précoce notamment chez les patients à haut risque.
Cartographie des ESV
Les outils mis à la disposition des électrophysiologistes pour cartographier les ESV offrent de très nombreuses possibilités avec une évolution très marquée vers l’imagerie. L’indication de mapping, donc d’ablation, se fera tout d’abord sur les symptômes, les critères Holter (généralement plusd e 10 000 ESV/24h), le traitement médical inefficace ou mal toléré, en insistant sur une bonne information du patient. Le taux de succès attendu est d’environ 90 % dans la chambre de chasse VD et 60 % dans la chambre de chasse VG, pour un taux de complication de 1 %.
Le premier outil est avant tout l’analyse du contexte clinique, la présence ou non d’une séquelle à l’échocardiographie, à I’IRM. Ensuite I’ECG fournit degrandes informations sur la localisation probable.Une négativité dans les dérivations V1/V2 avec transition lente orientera vers une origine droite, une grande positivité dans les dérivations inférieures vers une origine infundibulaire.
Il y a toutefois une incertitude sur le côté droit ou gauche lorsque l’on suspecte une origine septale, avec transition V1/V2 brutale. Un empâtement du QRS, une pseudo onde delta et un couplage variable > 60 ms feront suspecter une localisation myocardique profonde ou épicardique.
Lors de la procédure, les manœuvres de base permettront le plus souvent de se rapprocher le plus possible du foyer : analyse de la précession locale par rapport à I’ESV clinique, ou topostimulation pour reproduire le plus fidèlement possible la morphologie deI’ESV. Les outils de cartographies 3D permettent non seulement de reconstruire l’anatomie afin d’obtenir une très grande précision du geste, mais aussi de modéliser des cartes couleurs, pour préciser le plus finement la zone d’intérêt : cartes de précession /de précocité et cartes de topo stimulation.
L’évolution des cathéters de mapping sur un mode « haute densité » a permis aussi de gagner en vitesse d’exécution, précision, efficience. Certaines localisations nécessiteront différentes voies d’abord afin de mieux cartographier et ablater certaines ESV venant de la chambre chasse VG : voie antérograde transseptale, voie rétroaortique, mapping dans le sinus coronaire, parfois mapping épicardique…
Enfin, un outil très largement utilisé outre-Atlantique mais très peu en France, uniquement pour raison économique : l’écho intracardiaque avec fusion au système de cartographie 3D apporte encore plus de vitesse et de précision, notamment des structures délicates : cusps aortiques, anatomie coronaire, muscles papillaires, et possibilité de réaliser des procédures « 0 fluoroscopie ». Sans cet apport, il est souvent nécessaire de réaliser aupréalable un coroscanner avec fusion au système3D, ou une coronarographie perprocédure.
L’éventail des outils est donc très large, mais la maîtrise des outils classiques et traditionnels est un prérequis obligatoire avant toute chose !
Le score calcique de la valve aortique
Le score calcique de la valve aortique est calculé à partir de la même acquisition que celle utilisée pour le score calcique des artères coronaires, au moyen du même algorithme (Arthur Agatston).
Le score calcique de la valve aortique est corrélé à la masse de la valve, pesée après remplacement valvulaire chirurgical, ainsi qu’avec les paramètres échographiques de sévérité de la sténose (gradient transvalvaire moyen, surface aortique) sauf chez les sujets en AC/FA.
La valeur seuil (cut-off) pour évoquer une sténose serrée varie selon les études : elle est schématiquement de 1200 chez les femmes et 2000 pour les hommes. Dans ces conditions, la sensibilité et la spécificité du score aortique pour le diagnostic de sténose serrée sont d’environ 80 %.
Le score aortique est corrélé aux paramètres de dysfonction diastolique du ventricule gauche ; sa progression dans le temps est corrélée à la fréquence cardiaque de repos. La prévalence d’un score valvulaire aortique positif (différent de zéro) au sein d’une cohorte de patients ayant eu un score calcique coronaire varie en fonction du profil de population examinée (âge, sexe); elle se situe autour de 30 % en moyenne. Les scores calciques de la valve aortique et des coronaires ne sontpas corrélés entre eux.
En effet, les facteurs de risque associés à un score aortique élevé sont l’âge, l’HTA, l’obésité, une phosphatémie et une CRP élevée, mais le tabac, le diabète, et l’hypercholestérolémie ne sont pas des facteurs de risque du RAC.
Le score de la valve aortique a une valeur pronostique (risque de décès) documentée par de nombreuses études ; le bénéfice de la chirurgie est plus important si le score est élevé.
Dans le contexte d’un remplacement valvulaire percutané (TAVI), le score de lavalve aortique est un prédicteur du risque de décès à un an, et également du risque de fuite aortique postprocédurale. Il existe un risque accru de devoir implanter un PM si le score est élevé au voisinage de la cuspide droite.
En conclusion
Le score calcique de la valve aortique nous semble avoir deux intérêts en pratique quotidienne :
- Lors d’un score calcique coronaire banal, la mesure du score calcique de la valve aortique permet d’identifier les sujets ayant un score non nul ; ce résultat fait compléter les investigations par un échodoppler.
- Le score calcique étant corrélé à la sévérité hémodynamique du rétrécissement aortique et ayant une forte valeur pronostique, il peut aider à la décision thérapeutique dans les cas difficiles ; les patients dont le score est élevé sont ceux qui bénéficient le plus d’un remplacement valvulaire.
La cardioneuro-ablation
La prise en charge des patients faisant des syncopes vasovagales itératives et invalidantes est délicate.
Chez les patients jeunes et qui présentent des asystolies prolongées, il est fréquent de se retrouver dans une impasse thérapeutique. La tentation est alors forte de proposer une stimulation cardiaque, pourtant imparfaitement efficace et responsable de complications au long cours difficilement acceptables chez ces patients par ailleurs en bonne santé.
Dans ce contexte, la cardioneuro-ablation constitue une solution interventionnelle innovante et particulièrement efficace. Le principe de cette intervention est de détruire par radiofréquence les plexus ganglionnés paracardiaques. Ces structure scontiennent les neurones postsynaptiques parasympathiques par lesquels transitent la composante efférente cardioinhibitrice du réflexe vasovagal.
Cette composante cardioinhibitrice est alors complètement abolie, permettant dans la plupart des cas une amélioration symptomatique spectaculaire.
Ces plexus sont situés dans les amas graisseux de la partie postérieure du septum interatrial et peuvent donc être détruits par radiofréquence par voie percutanée avec un équipement et un déroulé de procédure similaires à ceux d’une ablation de fibrillation atriale.
Même si le recul sur cette intervention est encore modeste, les résultats préliminaires suggèrent une excellente efficacité de la procédure, avec un effet qui ne s’estompe pas dans le temps, et un risque de complications très faible.
Les articles publiés sont sous la seule responsabilité de leurs auteurs. Les informations sur l’état actuel de la recherche et les données présentées sont susceptibles de ne pas etre validées par la commission d’AMM.

