
NOVEMBRE 2021

Editorial
Chers amis, c’est un plaisir et un honneur de réaliser mon premier éditorial en tant que Président et je tenais à vous remercier pour la confiance témoignée.
Cardionews a pris place dans votre quotidien sous l’impulsion de mon prédécesseur le Dr Cohen et sous la coordination de l’ancien Président le Dr Gauthier que je remercie chaleureusement.

LA MINUTE VASCULAIRE
ACST 2
LES MOTS MÉDICAUX
Nouvelle orthographe à l’usage des cardiologues.
par Jacques Gauthier
Les articles de nos experts
Vaccination anti-Covid-19 et myocardites…
Avec les millions de patients ayant bénéficié de la vaccination anti-Covid-19, on pouvait s’attendre à des effets indésirables concernant l’appareil cardio-vasculaire. Ce fut le cas en effet. Des poussées hypertensives ou des déstabilisations des traitements anti-hypertenseurs ont été décrites, même s’il est difficile, connaissant la prévalence de l’hypertension artérielle, méconnue ou non, et la proportion de ces hypertensions correctement traitées…
Des troubles du rythme (fibrillation auriculaire paroxystique, tachycardie de Bouveret, ESV…) et de la conduction (syncopes, malaises, bloc auriculo-ventriculaires, pauses sinusales…) mais là encore, l’incidence naturelle de ces troubles dans une population qui est somme toute assez âgée ne permet pas de conclure définitivement. Dans un numéro précédant, Denis Angoulvant de Tours, faisait un point précis sur Covid-19 et myocardites.
S’il reste important de souligner que les patients atteints de Covid-19 ont un risque de myocardite 16 à 18 fois plus élevé que les sujets non atteints par le Sars-Cov-2, ce risque est de 6 à 34 fois plus élevé chez les non-vaccinés par rapport aux vaccinés ! (1-2)
Il n’en demeure pas moins qu’en juillet 2021, le comité de sécurité des médicaments de l’EMA a conclu au risque très rare de survenue de myocardites et de péricardites chez les sujets jeunes après les vaccins “à mARN”, que ce soit Cominarty® ou Spikevax®, le plus souvent après la deuxième dose de vaccin ettrès majoritairement chez le sujet de sexe masculin. L’évolution de ces épisodes est généralement favorable après une prise en charge classique, même si de très rares décès ont été observés. Le résumé des caractéristiques du produit des deux vaccins a été implémenté dans ce sens, et les professionnels de santé prévenus de ce risque. Cela a donné lieu à des précautions d’emploi, voire des contre-indications relatives à la vaccination anti-Covid-19 chez certains patients. Ces conclusions sont actuellement réexaminées car de nouvelles analyses provenant des pays nordiques (Danemark, Suède, Norvège…) indiquent que ces pays ne vaccinent plus ou découragent les vaccinations de sujets de moins de 18 ans, voire de moins 30 ans, avec le vaccin Spikevax® à cause d’un risque de myocardite qui pourrait s’avérer supérieur à celui de son concurrent. L’Europe se penche sur cette question car des données contradictoires émanant des Etats Unis sont soumis pour publication par les Britanniques (3) : ils estiment ainsi la survenue de myocardites avec Comirnaty® à 6-7 cas par million de vaccinations complètes, avec un recul de 90 millions de vaccinés, contre 3 à 4 cas par million de vaccinations complètes avec Spikevax et un recul de64 millions de vaccinés complets. La tendance sembleinversée pour l’Europe dans leur étude. Des données définitives et une éventuelle modification des résumés des caractéristiques des vaccins pourraient s’ensuivre.
Il n’en demeure pas moins que ce risque est très rare et ne saurait faire réfuter la vaccination à un sujet à risque de Covid-19 grave. Tout au plus peut on la discuter en fonction du rapport bénéfice-risque individuel, en cas d’épisode intercurrent de myocardite ou de péricardite entre les deux doses de vaccins. Dans tous les cas un diagnostic précis, incluant le RMN, un suivi d’évolution circonstancié et une résolution complète de l’épisode inflammatoire (myocardite ou péricardite) sont nécessaires avant d’envisager la complétion de la vaccination.
1. Singer ME et al, medRxiv-July 2021 (pre-print)
2.Block et al, CDC pre-publication 2021
3.Lane S et al, BMJ
Athérome coronaire du sujet jeune : une réalité
Il est possible depuis quelques années d’identifier la présence d’un athérome coronaire chez les sujets de moins de 50 ans grâce au scanner coronaire et au score calcique.
L’athérome coronaire n’est pas exceptionnel dans cette catégorie d’âge : dans l’étude du CAC-CONSORTIUM (66 363 personnes), 13% des sujets âgés de moins de 30 ans ont un score supérieur à 0, et ce chiffre monte à 34% dans la tranche d’âge des 30-49 ans !
Le risque associé à la présence d’un athérome coronaire précoce n’est pas anodin ; en fait il semble même supérieur au risque conféré par un score identique chez un sujet plus âgé.
L’étude franco-espagnole SAFEHEART concerne 1624 sujets présentant une hypercholestérolémie familiale ; l’âge moyen est de 48 ans, avec 45% d’hommes et un suivide 2,7 années. Un score calcique > 100 indique un risque 32 fois supérieur au risque des sujets dont le score est égal à zéro. La prise en compte simultanée du score de risque clinique et du score calcique améliore significativement l’estimation du pronostic.
Dans un travail plus ancien concernant 8 143 personnes suivies 5,6 ans, un sujet de moins de 45 ans ayant un score > 400 a un risque de décès 10 fois supérieur à un sujet de plus de 75 ans dont le score est égal à 0 ! Chez un sujet de moins de 45 ans, un score > 10 multiplie le risque d’accident par 72 (vs score 0).
Dans le groupe des 30-49 ans du CAC-CONSORTIUM, la mortalité cardiovasculaire des sujets ayant un score > 100 est 10 fois supérieure à celle dont le score est nul. La présence d’un score très bas mais non nul (entre 1 et 10) confère un excédent de mortalité seulement dans le groupe des moins de 40 ans.
De cette rapide revue bibliographique, on peut retenir 2 points :
1. L’athérome coronaire est loin d’être exceptionnel avant 50 ans, et concerne environ 1 personne sur 3.
2. Un score calcique non nul chez un sujet de moins de 50 ans est assorti d’un risque élevé, même si le chiffre est bas.
Pour conclure
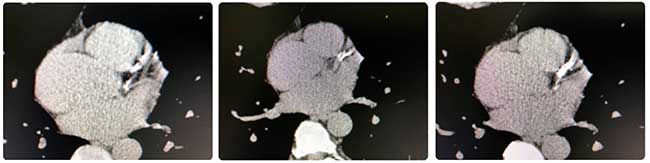
Rappelons que les sujets jeunes peuvent aussi avoir un athérome coronaire très évolué : ci-dessous l’exemple d’un sujet de 50 ans présentant des facteurs de risque familiaux, score calcique 1 752.
Le dépistage de la FA est un véritable enjeu
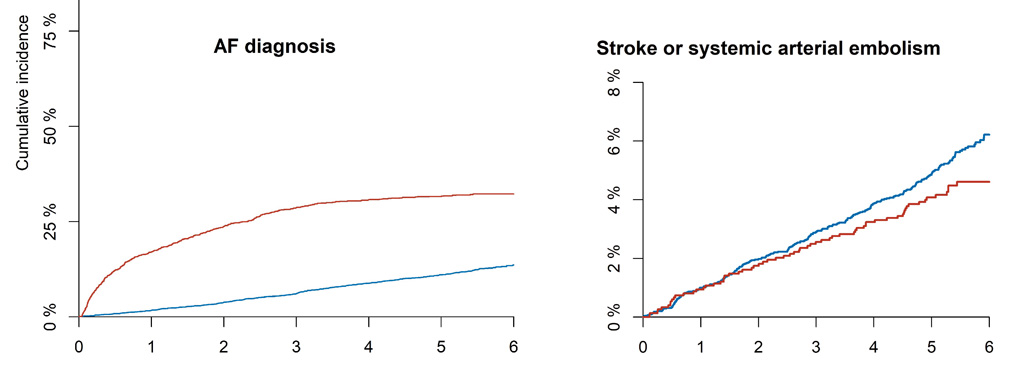
Cet essai s’adresse à une population à risque > 70 ans avec un facteur de risque HTA, DNID, IC ou AVC.
Dépistage de la FA par un suivi conventionnel (SC) ou par holter implantable (HI). Toute FA détectée est mise sous anticoagulant. Le critère de jugement est la survenue d’un AVC ou d’une embolie systémique. Dans le groupe HI, 31,8% de FA sont détectées vs 12.2% dans le groupe SC, soit 3 fois plus, confirmant l’intérêt de la méthode.
AF detection
Pour autant, le critère primaire (AVC ou embolie systémique) survient dans 4,5% du groupe HI vs 5,6% dans le groupe SC, sans différence significative HR = 0,80 ; p = 0,11. Comment interpréter ce résultat négatif ?
Les 2 groupes bénéficient de l’anticoagulation, avec une détection plus précoce pour le groupe HI. Compte tenu d’un CHADSVasc à 4 soit un risque d’AVC annuel autour de 4%, la durée de l’étude est insuffisante pour montrer un résultat significatif qui se dessine malgré tout par la divergence des courbes.
Dépistage de la FA : des résultats à court-terme pour le long terme
Insuffisance cardiaque à fraction d’éjection réduite : la stratégie 4 piliers, 3 étapes
De nouvelles recommandations pour la prise en charge de l’insuffisance cardiaque (IC) viennent d’être éditées par la Société européenne de cardiologie et, concernant l’insuffisance cardiaque à fraction d’éjection réduite (IC FER), elles proposent une stratégie que l’on peut résumer par une expression :“4 piliers, 3 étapes”.
4 piliers
Les 4 piliers sont les 4 classes thérapeutiques qu’il faut introduire aussi rapidement que possible dès le diagnostic d’IC FER fait, diagnostic reposant sur la présence de symptômes ou signes d’IC associés à une fraction d’éjection ventriculaire gauche (FEVG) inférieure à 41%. Ces 4 classes comprennent un bêtabloquant, un antagoniste des récepteurs aux minéralocorticoïdes, un inhibiteur du cotransporteur-2 sodium glucose ou gliflozine et soit un IEC, soit un antagoniste des récepteurs à l’angiotensine 2 soit du sacubitril/valsartan. Parmi ces trois derniers traitements possibles, les IEC ont le plus haut niveau dans ces recommandations (IA) mais un des deux autres traitements peut être choisi par le médecins’il le souhaite à la place d’un IEC.
Particularités de cette stratégie : elle s’applique aussi bien chez un patient hospitalisé que chez un patient ambulatoire, l’ordre de prescription est laissé au choix du médecin, selon ses habitudes ou préférences et selon la situation clinique, les 4 classes thérapeutiques pouvant être prescrites d’emblée chaque fois que possible, seules les molécules ayant été évaluées dans des essais thérapeutiques contrôlés doivent être utilisées, en débutant selon le schéma d’utilisation des molécules par de faibles doses avec une augmentation progressive des doses pour atteindre la dose cible (celle évaluée dans les essais cliniques) ou la dose maximale tolérée.
En parallèle, les diurétiques peuvent être utilisés etadaptés à tout moment à la situation clinique.
3 étapes
La stratégie en trois étapes est simple.
- La première étape consiste à faire en sorte que les 4 piliers soient prescrits aussi précocement que possible, c’est l’étape “débuter le traitement”.
- La deuxième étapeconsiste à ce que, dans les 30 à 60 jours qui suivent, les doses cibles des traitements ou les doses maximales tolérées soient atteintes, c’est l’étape“optimiser le traitement”. On comprend que pour réussir cette étape, il faut organiser une logistique permettant de revoir le patient tous les 10 jours environ avec à chaque consultation une évaluation de l’état fonctionnel, de la tolérance au traitement et l’adoption d’une stratégie permettant d’augmenter les doses des molécules.
- La troisième étape consiste, une fois les doses cibles ou maximales tolérées atteintes, à réévaluer l’état fonctionnel du patient et la FEVG et à adapter alors le traitement si nécessaire (par exemple, envisager un défibrillateur ou une resynchronisation) et à fixer le rythme de surveillance, c’est l’étape “réévaluer, adapter, surveiller”.
Une fuite mitrale qui fait peur
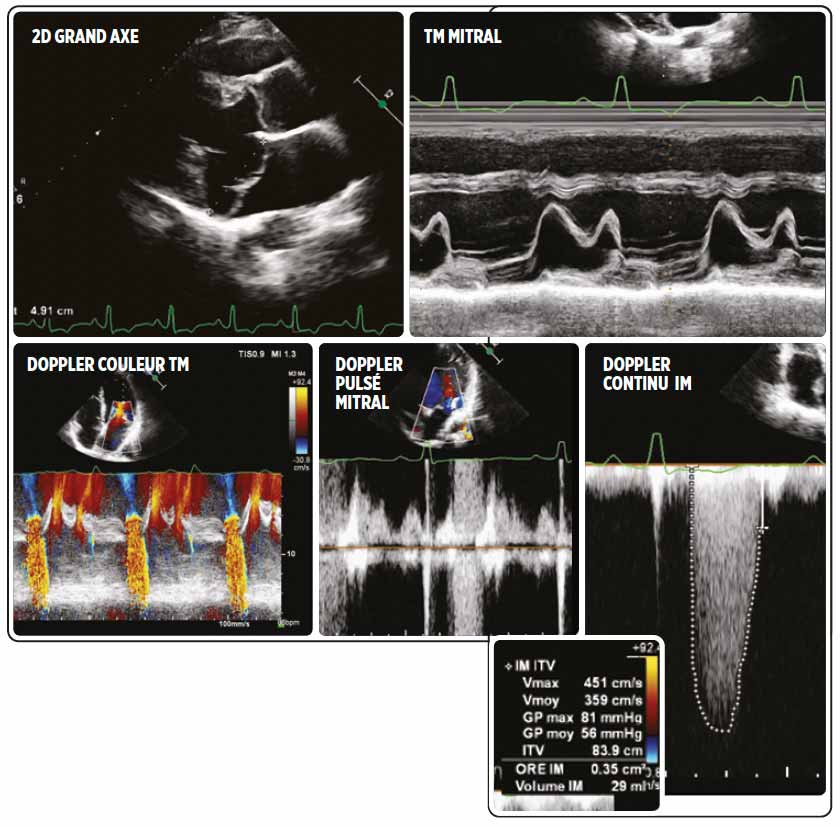
Madame C.. âgée de 38 ans, sportive, consulte pour un certificat d’aptitude à la compétition. L’écho retrouve une fuite mitrale mésotélé systolique sur un hyper Barlow, le volume régurgité est à 30 ml, témoignant d’une IM de faible grade sans contre-indication à la pratique du sport. (figure 1) 2 ans après, elle revient consulter pour une syncope à l’effort.
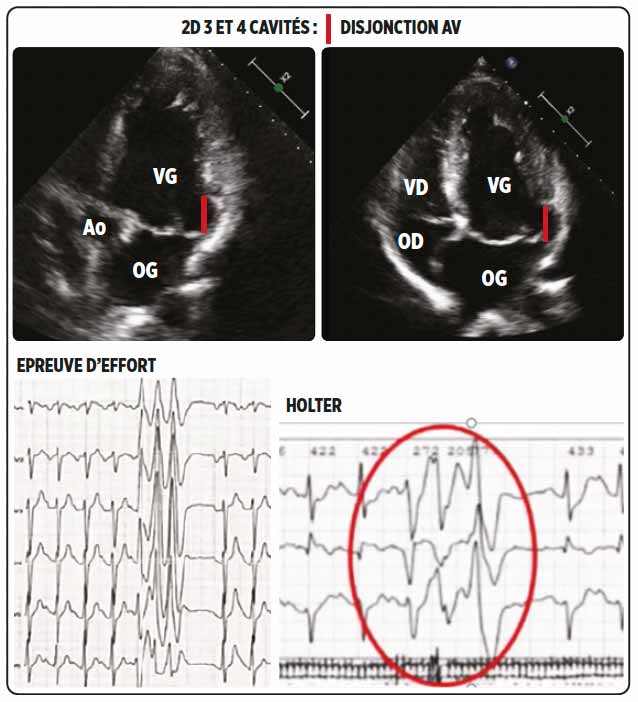
Des troubles du rythme ventriculaires sont retrouvés à l’épreuve d’effort, ainsi qu’au holter. Un nouvel écho retrouve une disjonction auriculo ventriculaire (espace libre entre l’insertion de la base du feuillet postérieur mitral et la paroi inféro-latérale). (figure 2)
La mort subite chez le sportif est une préoccupation majeure pour le cardiologue et la rédaction d’un certificat d’aptitude à la compétition lui incombe. Dans 2,6% de morts subites chez l’athlète (1) on retrouve un prolapsus mitral. Sur 650 jeunes (2) ayant fait une mort subite, 7% ont un prolapsus mitral. 83% d’entre eux ont une inversion de T en inférieur, une tachycardie ventriculaire à type de bloc de branche droit, et 70%, un prolapsus bivalvulaire avec disjonction AV. L’IRM ou l’autopsie retrouve une fibrose des piliers et de la paroi inférieure. Ces prolapsus “arythmogènes” concernent le plus souvent des femmes jeunes avec une onde T négative en inférieur, des ESV polymorphes, une tachycardie ventriculaire non soutenue, un prolapsus bivalvulaire avec éversion de la valve postérieure dans l’OG, et une disjonction annulaire ; à l’IRM, une fibrose des piliers et du 1/3 basal inféro-latéral.
Cette fibrose de remplacement intéresse plus largement la population des prolapsus mitraux sans disjonction ;sur une population de 400 prolapsus mitraux (3), elle est retrouvée dans 28% des cas, et est associée à un risque 4 fois plus fréquent d’arythmie ventriculaire. (tableau ci-dessous)
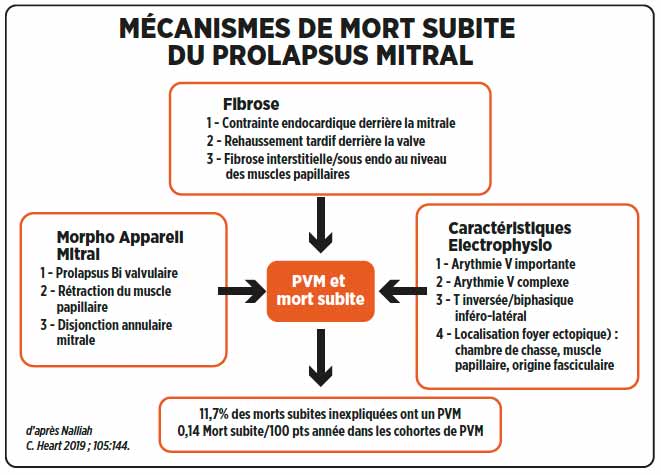
La prise en charge thérapeutique est encore mal codifiée (bêtabloquant souvent inefficace, défibrillateur, ablation d’un foyer ventriculaire, chirurgie réparatrice ?). Reconnaître cette entité justifie un bilan complet avec épreuve d’effort, IRM et avis rythmologique et une grande prudence quant à l’autorisation d’une activité sportive de compétition.
(1) Maron BJ, Doerer JJ, Haas TS et al. Sudden deaths in young competitive athletes: analysis of 1866 deaths in the United States, 1980-2006. Circulation. 2009 ;119 :1085-92
(2) Basso C, Perazzolo Marra M, Rizzo S et al. Arrhythmic Mitral Valve Prolapse and Sudden Cardiac Death. Circulation. 2019;140:952-64
(3) Constant dit Beaufils AL, Huttin O, Serfaty JM et al. Replacement Myocardial Fibrosis in Patients with Mitral Valve Prolapse: Relation to Mitral Regurgitation, Ventricular Remodeling, and Arrhythmia. Circulation. 2021; 143:1763-74.
Les articles publiés sont sous la seule responsabilité de leurs auteurs. Les informations sur l’état actuel de la recherche et les données présentées sont susceptibles de ne pas etre validées par la commission d’AMM.

