
Décembre 2023

Editorial
Merci pour votre présence au congrès de Marseille qui conserve sa vitalité avec une fréquentation stable validant l’intérêt des nombreuses sessions proposées dans les thématiques de notre exercice quotidien.

Le don d’organes et la greffe sauvent des vies !
Julien Charpentier (Paris)
La transplantation d’organe est dans certaines défaillances terminales d’organes le seul traitement à proposer.
LA MINUTE VASCULAIRE
Incidence des AVC en fonction de la présentation clinique de la sténose carotide

LES MOTS MÉDICAUX
Workaholisme
En publiant les confessions, d’un workaholic en 1971, Wayne Oates met en lumière, l’addiction comportementale au travail (ou ergomanie) qui prend place entre l’implication louable et le burnout.
par Jacques Gauthier (Cannes)
Les articles de nos experts
Les microbleeds (MB) cérébraux : Impact et signification en pratique cardiologique ?
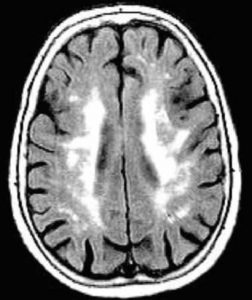
Les microsaignements ou microbleeds (MB) intracérébraux sont des lésions hémorragiques de petite taille uniquement visibles en IRM sous la forme d’hyposignaux arrondis en séquence écho de gradient (figure 1). Associés à la présence de leucopathie vasculaire (figure 2) et d’infarctus lacunaires (de petite taille), les MB sont considérés comme des marqueurs de microangiopathie cérébrale et témoignent de sa sévérité. L’IRM cérébrale reste l’imagerie de choix pour caractériser ce phénotype radiologique.
Figure 1 : Microbleeds cérébraux en IRM T2
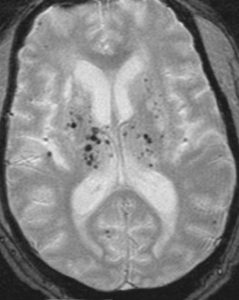
Figure 2 : Leucopathie vasculaire en IRM FLAIR
Les MB sont plus fréquents chez les patients hypertendus (OR = 3,9 [2,4-6,4]) et/ou diabétiques (OR = 2,2 [1,2-4,2]), principaux facteurs de risque du développement d’une microangiopathie cérébrale d’origine artérioscléreuse. Les MB sont également associés à d’autres types de microangiopathies cérébrales comme l’angiopathie amyloïde cérébrale sporadique (16-38 %) ou héréditaire (69 %), caractérisée par l’accumulation de dépôts amyloïdes dans la paroi des petites artères. Cette microangiopathie cérébrale expose aux risques d’ischémie, d’hémorragie intracérébrale (HIC) et de démence vasculaire. Il a été démontré que la présence de MB est un facteur de risque indépendant de survenue d’HIC mais également d’infarctus cérébraux. Ainsi, la prévalence des MB est plus élevée chez les patients avec un antécédent d’ischémie (34,4 % [31,5-37,3]) ou d’hémorragie cérébrale (60,4 % [57,2-63,6]) que dans la population générale (5 % [3,9-6,2]).
Une évaluation clinico-radiologique neurologique
Fortuite ou non, la découverte de MB devra faire l’objet d’une évaluation clinico-radiologique neurologique afin d’en déterminer les causes et d’évaluer le risque neurovasculaire. Quelle que soit l’étiologie, et particulièrement en cas de microangiopathie hypertensive, une recherche d’hypertension artérielle, facteur de risque modifiable, ainsi que son contrôle optimal, devront être réalisés par le cardiologue afin de réduire l’évolution de la maladie et ses risques associés.
Proposer un suici clinico-radiologique
Un suivi clinico-radiologique pourra être proposé pour suivre l’évolutivité de la microangiopathie et assurer une optimisation du traitement. L’évaluation du risque d’HIC est d’autant plus pertinente quand une indication de traitement antithrombotique est posée. La répartition lobaire des MB, témoignant d’une possible angiopathie amyloïde cérébrale (AAC) sous-jacente, exposerait à un risque essentiellement d’HIC.
La charge en MB semble être également associée au risque d’HIC. Cependant, en l’état actuel des connaissances, les MB, hors contexte d’AAC, ne peuvent pas à eux seuls représenter une contreindication absolue aux antithrombotiques, d’autant plus qu’ils sont également associés à un risque ischémique. L’AAC, dont la probabilité diagnostique repose sur les critères de Boston, et exposant essentiellement à un risque d’HIC spontanée élevé, pourra faire remettre en cause l’usage des antithrombotiques.
L’évaluation de la balance bénéfice/risque d’un traitement antithrombotique dans le contexte de présence de MB devra toujours faire l’objet d’une prise en charge et d’un suivi cardio-neurologique conjoint incluant un excellent contrôle tensionnel.
Les traitements des dyslipidémies : quel avenir ? – PARTIE 2 : les nouvelles cibles
Si l’augmentation du HDL-cholestérol a été jusqu’à présent un échec pour réduire le risque cardiovasculaire (CV), plusieurs autres voies restent explorées.
Baisser le LDL : plus fortement ou plus longtemps
Le bénéfice clinique de la baisse du LDL-cholestérol (LDL-c) est un acquis scientifique solide. Le développement de nouvelles molécules diminuant le LDL-c poursuit trois objectifs :
- offrir une nouvelle option en cas d’intolérance aux statines,
- diminuer plus encore le LDL-c en association aux statines,
- prolonger l’efficacité de la diminution du LDL-c.
À cet égard, l’inclisiran permet une diminution de plus de 50 % du LDL-c avec une injection souscutanée tous les 6 mois.
La Lp(a)
Deux molécules originales sont évaluées dans des essais thérapeutiques afin de savoir si la diminution de la Lp(a) peut apporter un bénéfice clinique.
L’étude HORIZON (résultats prévus en 2025), évalue un oligonucléotide antisens (ONAS), le pelacarsen, en une injection sous-cutanée à 80 mg une fois par mois chez 8 324 patients ayant un taux de Lp(a) supérieur à 69 mg/dl et une maladie CV.
L’étude OCEAN (a) Outcomes évalue un agent interférant avec l’ARN, l’olpasiran chez 6 000 patients ayant une maladie coronaire et un taux de Lp(a) au moins égal à 200 nmol/L.
Les triglycérides et l’apoCIII
S’il n’y a aucune preuve que la diminution des triglycérides (TG) permette de diminuer le risque d’événements CV ou celui de pancréatite, les recherches restent actives dans ce domaine, notamment par une action contre l’apoCIII, une protéine sécrétée par le foie jouant un rôle dans le métabolisme des TG.
Des études ont montré qu’une une perte de fonction de l’apoCIII est associée à une diminution de 40 % des taux de TG et de 40 % du risque de maladie CV.
L’évinacumab, un anticorps monoclonal, inhibiteur de l’ANGPTL3 (angiopoietin like 3) diminue le LDL-c et a une autorisation dans certains pays pour la prise en charge des hypercholestérolémies familiales.
Comme il diminue aussi les TG de 80 %, il est en cours d’étude de phase III chez des patients ayant une hypertriglycéridémie supérieure à 10 g/l afin d’évaluer s’il peut réduire le risque de pancréatite et accessoirement le risque CV.
Le volanesorsen un ONAS qui diminue de 84 % l’ApoCIII a une autorisation européenne pour la prévention des pancréatites mais la survenue de thrombocytopénie pourrait contrarier son développement.
D’autres ONAS dirigés contre l’ApoCIII sont en développement, comme l’AKCEA-APOCIIILRx et l’olezarsen (AROAPOC31001) et n’ont pas d’effets indésirables notés. Des essais évaluant leurs effets sur les événements CV sont en discussion et un essai ayant inclus 1312 patients ayant une maladie CV évalue l’effet de l’olezarsen sur la maladie coronaire quantifiée en coroscanner.
Dis-moi quelle est ta FA ?
Le traitement anticoagulant (AC) prévient la survenue des complications thromboemboliques de la FA. Mais en l’absence d’une FA documentée par un ECG, les ACs augmentent le risque d’hémorragie, par exemple chez les patients ESUS, sans démontrer de bénéfice.
Une FA est souvent détectée après la survenue d’un AVC, justifiant la démarche d’un diagnostic précoce pour démarrer un traitement AC.
L’étude LOOP s’est proposée d’implanter un holter chez des patients à risques de FA (CHADS 4). Sur 3 ans 32I% de FA détectées (>6mn) vs 12I% en suivi conventionnel, qui a permis de débuter un traitement AC. Aucun bénéfice sur la survenue d’AVC ou embolie systémique (5I%).
À l’ESC 2023, NOAH-AFNET 6 s’adresse aux patients âgés présentant des épisodes atriaux rapides (>170/mn >6Imn) (AHRE) dans les mémoires de leur stimulateur implanté et des facteurs de risque cliniques d’AVC. L’anticoagulation avec edoxaban à la dose approuvée pour la FA ne réduit pas un résultat composite d’AVC, d’embolie systémique ou de décès cardiovasculaire.
Comme prévu, l’anticoagulation augmente les saignements majeurs. Le taux d’AVC était faible avec et sans anticoagulation.
Sur la base de ces résultats, faut-il anticoaguler les patients avec des « FA non cliniques » diagnostiquées lors d’enregistrements numériques au long cours ? La réponse est non. Ces patients doivent être traités sans anticoagulation jusqu’à ce que la FA soit diagnostiquée par ECG conventionnel à la consultation ; dans l’attente de démembrer la « cardiomyopathie atriale » dont la FA ne serait qu’un symptôme ?
Peut-on se passer de l’aspirine chez les patients coronariens ?
L’aspirine a représenté ces dernières décennies la pierre angulaire du traitement anti-thrombotique des patients coronariens.
Dans le cadre des syndromes coronariens aigus (SCA) et/ou bénéficiant d’une angioplastie coronaire percutanée avec stents (APC), la bithérapie anti-agrégante plaquettaire (BAAP) a permis une réduction des récidives ischémiques et des thromboses de stent mais au prix d’un surcroît d’hémorragies par rapport à l’aspirine en monothérapie. Les études randomisées TRITON TIMI38 et PLATO ont démontré une supériorité de la nouvelle génération des inhibiteurs des récepteurs P2Y12 représentés par le Prasugrel et le Ticagrelor par rapport au Clopidogrel sur les événements ischémiques dans le cadre des SCA, avec pour bémol une augmentation des événements hémorragiques.
Par conséquent, la BAAP associant aspirine et clopidogrel est la référence chez les patients coronariens chroniques revascularisés par ACP, tandis que la BAAP par aspirine et prasugrel ou ticagrelor est l’association préférentielle chez les patients en post SCA.
L’aspirine reste donc une composante clé de la stratégie et est recommandée par la majorité des sociétés savantes, mais un nouveau concept visant à raccourcir la durée de traitement par aspirine a émergé, dans le but de diminuer les hémorragies tout en conservant les bénéfices ischémiques (figure ci-dessous).
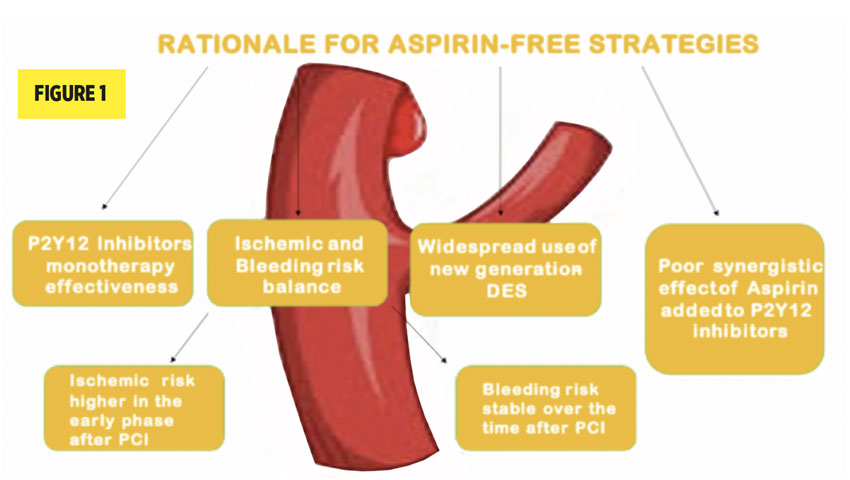
En effet, on sait que les hémorragies majeures surviennent principalement les premiers mois alors que les événements ischémiques ont un effet cumulatif et linéaire après les 6 premiers mois. Ceci est particulièrement vrai pour les patients dit « fragiles » chez qui la BAAP de courte durée d’un mois est recommandée, suivie d’une monothérapie.
Les stratégies de « dé-escalade » de la BAAP ont été évaluées ces dernières années.
Les études TROPICAL, TOPIC, TWILIGHT et TICO ont montré que la diminution de l’intensité de la BAAP permet une diminution des hémorragies, principalement mineures, sans excès d’événements ischémiques, chez des patients n’ayant pas eu d’événements cliniques dans les 3 premiers mois post SCA ou ACP.
Les études SMART-CHOICE et STOPDAPT-2 ont montré des résultats similaires avec une courte BAAP de 1 à 3 mois versus 12 mois. Cependant, l’étude STOPDAPT-2 a rapporté un excès d’événements ischémiques chez les patients en post SCA incitant à conserver une approche personnalisée tenant compte de l’anatomie coronaire, du nombre et de la longueur de stents et du contrôle des facteurs de risque. L’étude HOST-EXAM encourage à l’utilisation d’une monothérapie par prasugrel après une courte BAAP, avec une confirmation nécessaire sur une étude de plus grande taille.
L’étude STOP DAPT3 présentée à l’ESC à Amsterdam confirme qu’il faut conserver au moins un mois la BAAP, y compris chez les patients à haut risque hémorragique, car un excès de thromboses subaiguës de stents a été observé.
Conclusions
La BAAP pendant 12 mois reste la stratégie préférentielle des dernières recommandations de l’ESC dans le post-SCA. Cette stratégie « conservatrice » est cependant concurrencée par les nombreuses données évaluant la dé-escalade en passant d’une bithérapie puissante à une bithérapie moins puissante, ou à une monothérapie par un inhibiteur des P2Y12 qui a montré sa supériorité à l’aspirine en monothérapie dans les études PANTHER et TALOS. Le traitement reste donc individualisé mais l’aspirine n’est plus incourtounable en restant conscient qu’il faudra du temps pour changer les dogmes.
Tous les patients présentant un RAC serré asymptomatique justifient-ils un remplacement valvulaire ?
C’est l’un des grands débats actuels à la suite des deux publications AVATAR (1) et RECOVERY (2), préconisant un remplacement valvulaire (RVA) précoce dans les RAC serrés asymptomatiques.
Si le RAC peu ou moyennement serré nécessite une simple surveillance, “a contrario”, le RAC symptomatique est une urgence (Ross Circulation 1968) de même que les RAC serrés asymptomatiques dits à risques. Les “autres” vrais asymptomatiques justifient un suivi “actif” tous les 6 mois (éducation du patient, épreuve d’effort afin de s’assurer du caractère vraiment asymptomatique).
La 1ère des questions : le patient est-il vraiment asymptomatique ?
Il est nécessaire de réaliser un test d’effort. Ce test est sans danger et a une valeur pronostique majeure : pas de mort subite chez les patients ayant un test négatif contre 5 % en cas de test positif. Les faux asymptomatiques représenteraient 15 à 67 % des RAC serrés (3).
Figure 1 : Écho d’effort dans un RAC serré d’un faut asymptomatique
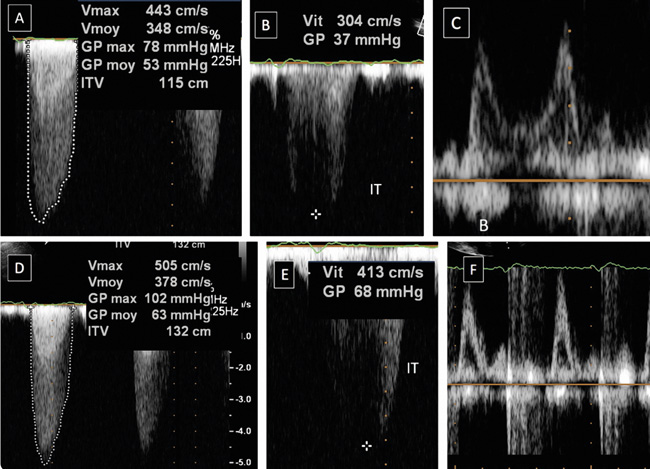
(a) v max au repos (4,4 m/s)
(b) paps 37+5
(c) profil mitral de type trouble de la relaxation
(d) v max à l’effort 5 m/s
(e) paps d’effort 68+5
(f) profil mitral d’effort restrictif
La 2e grande question
Quels sont les RAC asymptomatiques à risques ? Les RAC à risques doivent être identifiés régulièrement en raison de l’évolutivité des RAC : V max supérieure à 5m/s, BNP élevé > de 3 fois la normale, majoration annuelle de la V max ≥ 0,3 m/s, calcification sévère (écho ou scanner), fraction d’éjection < 55 %. Ces critères en font des candidats à un RVA même en l’absence de symptômes et ne justifient pas d’un test à l’effort.
| Etape 1 | • Confirmer le caractère serré du RAC et l’absence de symptômes • Erreurs de mesure en écho • Pratiquer un scanner pour confirmer la sévérité • Faire un test à l’effort pour confirmer le caractère asymptomatique |
| Etape 2 | • Rechercher les RAC à risques à court terme • RAC très sévère : V max> 5m/s • Importantes calcifications au scanner et progression rapide > 0,3 m/s par an • Augmentation du BNP (> 3 fois la normale) • FEVG< 55% • Retentissement extra valvulaire ≥ 2 |
| Etape 3 | • Confirmer le faible risque de mortalité après chirurgie de RVA ou TAVI |
| Etape 4 | • Confirmer la durabilité prouvée de la prothèse valvulaire comparativement à la durée de vie escomptée |
>>>>> Envisager un RVA chirurgical ou un TAVI
D’après Bernard Iung 1, Luc Pierard 2, Julien Magne 3,4, David Messika- Zeitoun 5, Philippe Pibarot 6, and Helmut Baumgartner EHJ 2023Heart Rythm 2017
Quels sont les nouveaux critères proposés ?
- Le strain : un strain détecte des dysfonctions ventriculaires gauches infra cliniques. Son altération a une meilleure valeur pronostique que la simple FE. Il serait proportionnel au degré de fibrose myocardique. Mais les seuils proposés sont très variables, le caractère charge dépendant est particulièrement sensible dans le cadre du RAC ; un strain abaissé dans cette population souvent âgée peut être liée à de nombreux autres facteurs de comorbidités.
- L’IRM : on a voulu associer l’évaluation du degré de fibrose pour définir le moment optimal du RVA. Sans parler de la disponibilité et du coût de cet examen, il existe de nombreuses causes de fibrose chez les patients porteurs d’un RAC serré. Sans nier l’intérêt scientifique de tels travaux et en raison des limites de ces données dans cette population souvent âgée, il parait illusoire de disposer d’une IRM systématique et de décider d’un RVA sur les données du strain et de l’IRM.
Le staging cardiac damage : Une publication (4) a étudié les conséquences extravalvulaires dans la population de PARTNER II.
Les résultats ont été repris dans une population dite asymptomatique (5) : 14 % des patients avec une HTAP > 60 mm hg, une dysfonction ventriculaire droite, un bas débit etc), difficilement compréhensibles chez de vrais asymptomatiques. D’où un “raccourci” pour préconiser un RVA systématique.
L’étude RECOVERY (5) et l’étude AVATAR (6) : études randomisées sur de petites populations de RAC très serrés dits asymptomatiques, opérés précocement comparés à un suivi médical, avec une meilleure survie pour le groupe chirurgical ; une définition minimaliste des asymptomatiques (l’absence de symptômes rapportés, pas ou peu d’évaluation à l’effort, pas de suivi dans le groupe médical).
L’absence de suivi médical dans le groupe témoin non opéré peut aisément expliquer les résultats en faveur d’un RVA précoce.
Le RAC est un problème de santé publique, intéressant 2 à 6 % de la population au-delà de 65 ans, pourcentage augmentant avec le vieillissement de la population. Les défenseurs de l’intervention précoce considèrent que l’attitude de surveillance active a du sens, mais qu’en pratique, son application est limitée par la sous-utilisation de l’épreuve d’effort et le délai d’identification des symptômes, faisant plutôt la critique de l’absence de surveillance et de la sous médicalisation de ces populations qu’une conviction profonde du bénéfice à un RVA précoce. D’où une attitude radicale afin de ne pas compromettre la sécurité et la qualité des résultats.
A l’inverse, les partisans d’une surveillance attentive considèrent qu’une intervention précoce expose à des complications inhérentes au RVA ; à long terme, expose à une réintervention précoce et à une mortalité plus importante que le faible risque de mort subite dans les vrais RAC asymptomatiques (< 1 % par an). Actuellement un tiers des RAC serrés symptomatiques ne reçoivent ni traitement ni de RVA. Une indication exponentielle de RVA asymptomatique risque de poser problème sur le plan éthique et les ressources de soins.
Deux protocoles en cours EARLY TAVR et EVoLVeD pourront peut-être donner une réponse à cette problématique mais pour cela il faudra attendre encore quelques années. Entre temps, le dépistage, l’éducation du patient, et une adhésion aux bonnes pratiques devraient permettre des indications raisonnables de RVA, non pas systématiques mais pondérées en mettant le patient au centre du débat.
(1) Banovic M, et al. the AVATAR trial. Circulation 2022.
(2) Kang DH, et al. N Engl J Med 2020.</em
(3) Rafique Am J Cardiol 2009.
(4) Généreux EHJ 2017.
(5) Tastet JACC 2019
(6) Kang NEJM 2020.
(7) Banovic Circulation 2022.

